Azufre: historia, propiedades, estructura, obtención, usos
El azufre es un elemento no metálico que lidera, por debajo del oxígeno, el grupo de los calcógenos de la tabla periódica. Se ubica específicamente en el grupo 16 con período 3, y es representado con el símbolo químico S. De sus isótopos naturales, el 32S es por mucho el más abundante (alrededor del 94% de todos los átomos de azufre).
Es uno de los elementos más abundantes de la Tierra, componiendo aproximadamente el 3% de su masa total. Es decir que si se tomara todo el azufre del planeta podrían construirse dos lunas amarillas; habría tres satélites en lugar de uno. Puede adoptar varios estados de oxidación (+2, -2, +4 y +6), por lo que sus sales son numerosas y enriquecen la corteza y núcleo terrestres.

El azufre es sinónimo de amarillo, malos olores e infierno. La razón principal de sus malos olores se debe a sus compuestos derivados; especialmente los gaseosos y orgánicos. Del resto, sus minerales son sólidos y presentan colores que incluyen el amarillo, gris, negro y blanco (entre otros).
Es uno de los elementos que más presenta un amplio número de alótropos. Puede encontrarse como moléculas pequeñas y discretas de S2 o S3; como anillos o ciclos, siendo el azufre ortorrómbico y monoclínico S8 los más estables y abundantes de todos; y como cadenas helicoidales.
No solo se encuentra en la corteza terrestre en forma de minerales, sino también en las matrices biológicas de nuestros cuerpos. Por ejemplo está en los aminoácidos cistina, cisteína y metionina, en proteínas de hierro, queratina y en algunas vitaminas. Asimismo está presente en los ajos, toronjas, cebollas, coles, brócoli y coliflor.
Químicamente es un elemento blando, y en ausencia de oxígeno forma minerales sulfurosos y sulfatos. Arde con una llama azulada y puede mostrarse como un sólido amorfo o cristalino.
Pese a ser indispensable para la síntesis del ácido sulfúrico, sustancia altamente corrosiva, y de adjudicársele desagradables olores, en realidad es un elemento benigno. El azufre puede almacenarse en cualquier espacio sin mayores precauciones, siempre y cuando se eviten incendios.
Índice del artículo
- 1 Historia del azufre
- 2 Propiedades
- 3 Estructura y configuración electrónica
- 4 Obtención ¿Dónde se encuentra el azufre?
- 5 Usos
- 6 Riesgos y precauciones
- 7 Referencias
El azufre es uno de los elementos más viejos de la historia de la humanidad; tal es así que su descubrimiento es incierto y no se sabe cuál de las civilizaciones antiguas lo empleó por primera vez (4000 años antes de Cristo). En las mismas páginas de la Biblia puede encontrársele acompañando al fuego infernal y los avernos.
Se cree que el supuesto olor a azufre del infierno tiene que ver con las erupciones volcánicas. Su primer descubridor seguramente debió toparse con minas de este elemento como tierras de polvo o cristales amarillos en las cercanías de un volcán.
Este sólido amarillento pronto demostró notables efectos curativos. Por ejemplo, los egipcios empleaban el azufre para tratar las inflamaciones de los párpados. También aliviaba la sarna y el acné, aplicación que hoy en día puede apreciarse en los jabones de azufre y otros artículos dermatológicos.
Los romanos utilizaban este elemento en sus rituales, como fumigante y blanqueador. Cuando arde libera SO2, gas que inundaba los aposentos mezclándose con la humedad y proporcionando un medio antibacteriano y capaz de aniquilar a los insectos.
Los romanos, al igual que los griegos, descubrieron la alta combustibilidad del azufre, por lo que se convirtió en sinónimo de fuego. El color de sus llamas azuladas debió iluminar los circos romanos. Se cree que los griegos, por su parte, utilizaron este elemento para crear armas incendiarias.
Los chinos por su lado aprendieron que mezclando el azufre con salitre (KNO3) y carbón creaban la pólvora negra material que pautó un vuelco histórico, y que despertó en las naciones de entonces grandes demandas e interés por este mineral.
Como si la pólvora no fuera una razón suficiente para codiciar el azufre, pronto surgió el ácido sulfúrico y sus aplicaciones industriales. Y con la vara del ácido sulfúrico se medía la cantidad de riqueza o prosperidad de un país en relación a sus niveles de consumo de este compuesto.
No fue hasta 1789 cuando el brillante químico Antoine Lavoisier pudo reconocer al azufre y clasificarlo como un elemento. Luego, en 1823 el químico alemán Eilhard Mitscherlich descubrió que el azufre puede cristalizar predominantemente de dos maneras: romboédrica y monoclínica.
La historia del azufre siguió el mismo cauce de sus compuestos y aplicaciones. Con la enorme importancia industrial del ácido sulfúrico, le acompañó la vulcanización de los cauchos, la síntesis de la penicilina, la explotación de minas, la refinación de crudos petroleros ricos en azufre, la nutrición de los suelos, etc.
Sólido quebradizo en forma de polvo o cristales. Su color es amarillo limón opaco, es insípido y carece de olor.
El azufre líquido es singular porque su color amarillo inicial se torna rojizo y se intensifica y oscurece si se somete a altas temperaturas. Cuando arde, despide llamas azules y brillantes.
32 g/mol.
115,21ºC.
445ºC.
160ºC.
232ºC.
2,1 g/mL. Sin embargo, otros alótropos pueden ser menos densos.
22,75 J/mol·K
105±3 pm.
2,58 en la escala de Pauling.
Los enlaces S-S son apolares porque ambos átomos de azufre poseen la misma electronegatividad. Esto hace que todos sus alótropos, cíclicos o en forma de cadenas, sean apolares; y por lo tanto, sus interacciones con el agua son ineficientes y no puede solubilizarse en ella.
No obstante, el azufre sí puede disolverse en solventes apolares tales como disulfuro de carbono, CS2, y aromáticos (benceno, tolueno, xileno, etc.).
El azufre puede formar varios iones, generalmente aniones. El más conocido de todos es el sulfuro, S2-. El S2- se caracteriza por ser voluminoso y una base blanda de Lewis.
Por ser una base blanda la teoría establece que tenderá a formar compuestos con ácidos blandos; como los cationes metálicos de transición, entre ellos el Fe2+, Pb2+ y Cu2+.
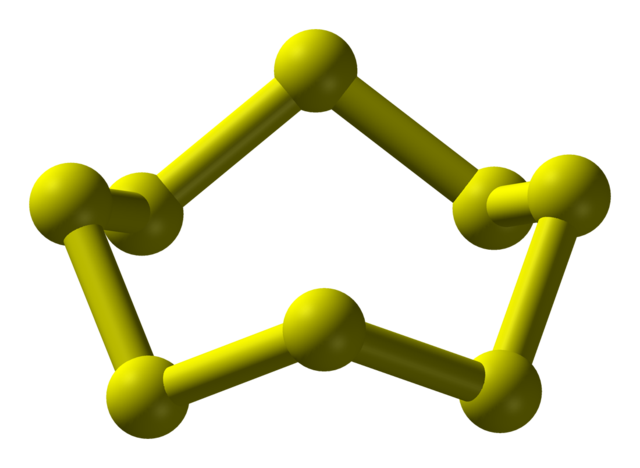
El azufre puede presentarse en una amplia variedad de alótropos; y estos a su vez tienen estructuras cristalinas que son modificadas bajo presiones y/o temperaturas diferentes. Por lo tanto, el azufre es un elemento rico en alótropos y polimorfos, y el estudio de sus estructuras sólidas representa una fuente inacabable de trabajos teórico-experimentales.
¿A qué se debe tal complejidad estructural? Para empezar, los enlaces covalentes en el azufre (S-S) son muy fuertes, siendo superados únicamente por los del carbono, C-C, y por el del hidrógeno, H-H.
El azufre, al contrario del carbono, no tiende a formar tetraedros sino boomerangs; que con sus ángulos se pliegan y anillan para estabilizar las cadenas sulfuradas. El anillo más conocido de todos, representando además el alótropo más estable del azufre, es el S8, la “corona azufrada” (imagen superior).
Nótese que todos los enlaces S-S del S8 parecieran boomerangs individuales, lo que resulta en un anillo con pliegues y plano en lo absoluto. Estas coronas S8 interactúan mediante fuerzas de London, orientándose de tal modo que logran crear patrones estructurales que definen un cristal ortorrómbico; llamado S8 α (S-α, o simplemente azufre ortorrómbico).
Polimorfos
La corona de azufre es uno de los tantos alótropos habidos para este elemento. El S8 α es un polimorfo de esta corona. Hay otros dos (entre los más importantes) llamados S8 β y S8 γ (S-β y S-γ, respectivamente). Ambos polimorfos cristalizan en estructuras monoclínicas, siendo el S8 γ es más denso (azufre gamma).
Los tres son sólidos amarillos. Pero, ¿cómo se obtiene cada polimorfo por separado?
El S8 β se prepara calentando el S8 α a 93°C, permitiendo luego su lento enfriamiento para enlentecer su transición de regreso a la fase ortorrómbica (la α). Y el S8 γ, por su lado, se obtiene cuando se funde S8 α a 150°C, permitiendo nuevamente que se enfríe lentamente; es el más denso de los polimorfos de la corona azufrada.
La corona S8 no es el único alótropo cíclico. Existen otros tales como S4, S5 (análogo al ciclopentano), S6 (representado por un hexágono al igual que el ciclohexano), S7, S9, y S10-20; este último quiere decir que puede haber anillos o ciclos que contengan de diez hasta veinte átomos de azufre.
Cada uno de ellos representa distintos alótropos cíclicos de azufre; y a su vez, para recalcarlo, tienen variedades de polimorfos o estructuras polimórficas que dependen de la presión y la temperatura.
Por ejemplo, el S7 tiene hasta cuatro polimorfos conocidos: α, β, γ, y δ. Los miembros o coronas de mayores masas moleculares son productos de síntesis orgánicas y no predominan en la naturaleza.
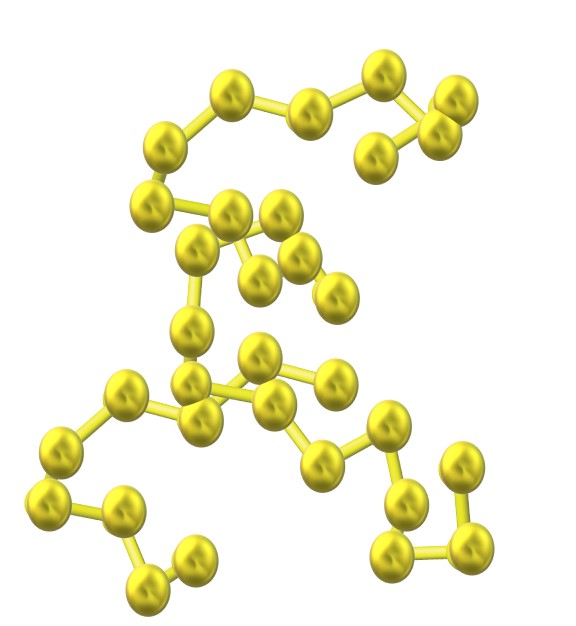
A medida que se incorporan más átomos de azufre a la estructura, su tendencia a anillarse disminuye y las cadenas azufradas permanecen abiertas y adoptan conformaciones helicoidales (como si fueran espirales o tornillos).
Y así, surge otra voluminosa familia de alótropos de azufre que no consiste de anillos o ciclos sino de cadenas (como la de la imagen superior).
Cuando estas cadenas S-S se alinean paralelamente en el cristal, atrapan impurezas y terminan definiendo un sólido fibroso llamado azufre fibroso, o S-ψ. Si entre estas cadenas paralelas hay enlaces covalentes que las interconectan (como sucede con la vulcanización del caucho), tenemos el azufre laminar.
Cuando el azufre S8 se funde se obtiene una fase líquida amarillenta que puede tornarse oscura si se incrementa la temperatura. Esto se debe a que se rompen enlaces S-S, y ocurre por lo tanto un proceso de despolimerización térmica.
Este líquido cuando se enfría muestra características plásticas y luego vidriosas; es decir, se obtiene un azufre vítreo y amorfo (S-χ). Su composición consta tanto de anillos como de cadenas azufrados.
Y cuando del azufre amorfo se obtiene una mezcla del alótropo fibroso y laminar se produce el Crystex, un producto comercial utilizado para la vulcanización del caucho.
Aunque se dejen de último no son menos importantes (o interesantes) que los alótropos de mayores masas moleculares. Las moléculas de S2 y S3 son las versiones sulfuradas del O2 y O3. En la primera dos átomos de azufre se unen con un doble enlace, S=S, y en la segunda hay tres átomos con estructuras de resonancia, S=S-S.
Tanto el S2 como el S3 son gaseosos. El S3 manifiesta una coloración rojo cereza. Los dos tienen suficiente material bibliográfico como para abarcar cada uno un artículo individual.
La configuración electrónica para el átomo de azufre es:
[Ne] 3s2 3p4
Puede ganar dos electrones para completar su octeto de valencia, y tener así un estado de oxidación de -2. Igualmente, puede perder electrones, empezando por dos en sus orbitales 3p, siendo su estado de oxidación de +2; si pierde dos electrones más, con sus orbitales 3p vacíos, su estado de oxidación será +4; y si pierde todos los electrones, será de +6.
El azufre forma parte de muchos minerales. Entre ellos están la pirita (FeS2), la galena (PbS), la covellita (CuS), y otros minerales de sulfatos y sulfuros. Al procesarlos no solo pueden extraérseles los metales, sino también el azufre después de una serie de reacciones reductivas.
Puede además obtenerse de manera pura en los respiraderos volcánicos, donde al elevarse la temperatura se funde y derrama cuesta abajo; y si se incendia, de noche lucirá como una lava azulada. Mediante labores arduas, y extenuantes trabajos físicos, el azufre puede recolectarse tal como se hacía con bastante frecuencia en Sicilia.
El azufre también puede hallarse en minas subterráneas, a las que se les hace bombear agua sobrecalentada para derretirlo y trasladarlo hacia la superficie. Este proceso de obtención se conoce como Proceso Frasch, actualmente poco utilizado.
Hoy en día la mayor parte del azufre proviene de la industria petrolera, pues sus compuestos orgánicos forman parte de la composición del crudo petrolero y sus refinados derivados.
Si un crudo o producto refinado es rico en azufre y se somete a hidrodesulfuración, liberará grandes cantidades de H2S (gas apestoso que huele a huevos podridos):
R-S-R + 2 H2 → 2 RH + H2S
Después el H2S se trata químicamente en el proceso Clauss, resumido con las siguientes ecuaciones químicas:
3 O2 + 2 H2S → 2 SO2 + 2 H2O
SO2 + 2 H2S → 3 S + 2 H2O
Se mencionan a continuación y de manera general algunos de los usos para el azufre:
– Es un elemento esencial tanto para las plantas como para los animales. Inclusive está presente en dos aminoácidos: cisteína y metionina.
– Es la materia prima para el ácido sulfúrico, compuesto involucrado en la preparación de innumerables productos comerciales.
– En la industria farmacéutica se destina para la síntesis de derivados sulfurosos, siendo la penicilina el más conocido de los ejemplos.
– Permite la vulcanización de los cauchos al interconectar las cadenas poliméricas con enlaces S-S.
– Su color amarillo y sus mezclas con otros metales lo hacen deseable en la industria de los pigmentos.
– Mezclado con una matriz inorgánica, como arena y rocas, se prepara hormigón y asfalto de azufre para el reemplazo del bitumen.
El azufre por sí solo es una sustancia inofensiva, no tóxica y tampoco representa riesgos potenciales, a menos que reaccione para formar otros compuestos. Sus sales de sulfato no son peligrosas y pueden manipularse sin mayores precauciones. No ocurre así, sin embargo, con sus derivados gaseosos: SO2 y H2S, ambos sumamente tóxicos.
Si está en fase líquida puede causar graves quemaduras. Si se engulle en grandes cantidades puede desencadenarse la producción de H2S en los intestino. Por lo demás, no representa ningún riesgo para quien lo mastique.
En términos generales el azufre es un elemento seguro que no requiere demasiadas precauciones, excepto mantenerlo alejado del fuego y de agentes oxidantes fuertes.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Laura Crapanzano. (2006). Polymorphism of sulfur: Structural and Dynamical Aspects. Physics [physics].Université Joseph-Fourier – Grenoble I. English. fftel-00204149f
- Wikipedia. (2019). Allotropes of sulfur. Recuperado de: en.wikipedia.org
- Meyer Beat. (1976). Elemental sulfur. Chemical Reviews, Vol. 76, No. 3.
- Dr. Doug Stewart. (2019). Sulfur Element Facts. Chemicool. Recuperado de: chemicool.com
- Donald W. Davis and Randall A. Detro. (2015). Sulfur History. Georgia Gulf Sulfur Corporation. Recuperado de: georgiagulfsulfur.com
- Helmenstine, Anne Marie, Ph.D. (11 de enero de 2019). 10 Interesting Sulfur Facts. Recuperado de: thoughtco.com
- Boone, C.; Bond, C.; Hallman, A.; Jenkins, J. (2017). Sulfur General Fact Sheet; National Pesticide Information Center, Oregon State University Extension Services. npic.orst.edu
