Tungsteno: historia, propiedades, estructura, usos
El tungsteno, wolframio o volframio es un metal de transición pesado cuyo símbolo químico es W. Se ubica en el período 6 con grupo 6 de la tabla periódica, y su número atómico es el 74. Su nombre tiene dos significados etimológicos: piedra dura y espuma de lobo; del segundo se debe a que este metal también se conozca como wolframio.
Es un metal grisáceo plateado y, aunque sea frágil, posee una gran dureza, densidad, y altos puntos de fusión y ebullición. Por lo tanto, se ha usado en todas aquellas aplicaciones que involucran altas temperaturas, presiones o fuerzas mecánicas, tales como en los taladros, proyectiles, o filamentos emisores de radiaciones.

El uso más conocido para este metal, a nivel cultura y popular, es en los filamentos de las bombillas eléctricas. Quien las haya manipulado se dará cuenta de lo frágiles que son; sin embargo, no están hechas de tungsteno puro, el cual es maleable y dúctil. Además, en matrices metálicas como las aleaciones, brinda excelentes resistencias y durezas.
Se caracteriza y distingue por ser el metal con el punto de fusión más elevado, y por ser además más denso que el mismo plomo, superado únicamente por otros metales como el osmio e iridio. Asimismo, es el metal más pesado que se conozca que cumple con algún rol biológico en el organismo.
En la mayoría de sus compuestos iónicos participa el anión tungstato, WO42-, el cual puede polimerizarse para originar clusters en medio ácido. Por otro lado, el tungsteno puede formar compuestos intermetálicos, o sinterizarse con metales o sales inorgánicas para que sus sólidos adquieran distintas formas o consistencias.
No es muy abundante en la corteza terrestre, habiendo por tonelada de la misma apenas 1,5 gramos de este metal. Además, por ser un elemento pesado, su procedencia es intergaláctica; específicamente de las explosiones de las supernovas, las cuales debieron arrojar “chorros” de átomos de tungsteno hasta nuestro planeta durante su formación.
Índice del artículo
- 1 Historia
- 2 Propiedades
- 2.1 Apariencia física
- 2.2 Número atómico
- 2.3 Masa molar
- 2.4 Punto de fusión
- 2.5 Punto de ebullición
- 2.6 Densidad
- 2.7 Calor de fusión
- 2.8 Calor de vaporización
- 2.9 Capacidad calorífica molar
- 2.10 Dureza de Moh
- 2.11 Electronegatividad
- 2.12 Radio atómico
- 2.13 Resistividad eléctrica
- 2.14 Isótopos
- 2.15 Química
- 2.16 Clustering ácida
- 3 Estructura y configuración electrónica
- 4 Obtención
- 5 Usos
- 6 Riesgos y precauciones
- 7 Referencias
La historia del tungsteno o wolframio tiene dos rostros al igual que sus nombres: uno suizo, y el otro alemán. En los años 1600, en regiones actualmente ocupadas por Alemania y Austria, los mineros trabajaban en las extracciones de cobre y estaño para producir bronces.
Para entonces los mineros se encontraron con una espina en el proceso: había un mineral sumamente difícil de fundir; mineral que consistía de wolframita, (Fe, Mn, Mg)WO4, el cual retenía o “devoraba” el estaño tal como si fuera un lobo.
De ahí se debe la etimología para este elemento, ‘wolf’ de lobo en español, un lobo que comía estaño; y ‘ram’ de espuma o crema, cuyos cristales se asemejaban a un largo pelaje negro. Fue así que el nombre ‘wolfram’ o ‘wolframio’ surgió en honor a estas primeras observaciones.
En 1758, por el lado suizo a un mineral parecido, la scheelita, CaWO4, se le nombró ‘tung sten’, que significa ‘piedra dura’.
Ambos nombres, wolframio y tungsteno, son ampliamente utilizados de manera intercambiables, dependiendo únicamente de la cultura. En España, por ejemplo, y en el oeste europeo, se conoce más a este metal por wolframio; mientras que en el continente americano el nombre tungsteno predomina.
Se sabía entonces que entre los siglos XVII y XVIII había dos minerales: la wolframita y la scheelita. Pero, ¿quién atisbó que había en ellos un metal diferente a los otros? Solamente podían caracterizárseles como minerales, y fue en 1779 que el químico irlandés Peter Woulfe analizó cuidadosamente la wolframita y dedujo la existencia del wolframio.
Por el lado suizo, nuevamente, Carl Wilhelm Scheele en 1781 pudo aislar el tungsteno como WO3; y aún más, obtuvo el ácido túngstico (o wolfrámico), H2WO4 y otros compuestos.
Sin embargo, esto no era suficiente para llegar al metal puro, pues hacía falta reducir este ácido; esto es, someterlo a un proceso tal que se desenlazara del oxígeno y cristalizara como metal. Carl Wilhelm Scheele no disponía de los hornos ni la metodología apropiados para esta reacción química de reducción.
Es aquí donde entraron en acción los hermanos españoles d’Elhuyar, Fausto y Juan José, quienes redujeron ambos minerales (wolframita y scheelita) con carbón, en la ciudad de Bergara. A ellos dos se les conceden el mérito y honor de ser los descubridores del wolframio o tungsteno metálico (W).

Al igual que otros metales, sus usos definen su historia. Entre los más destacados para finales del siglo XIX, estaban las aleaciones acero-tungsteno, y los filamentos de tungsteno para reemplazar a los de carbono dentro de las bombillas eléctricas. Se puede decir que las primeras bombillas, tal como las conocemos, fueron comercializadas en 1903-1904.
Es un metal grisáceo plateado y lustroso. Frágil pero de gran dureza (no confundir con tenacidad). Si la pieza es de elevada pureza se torna maleable y dura, tanto o más como varios aceros.
74.
183,85 g/mol.
3422ºC.
5930ºC.
19,3 g/mL.
52,31 kJ/mol.
774 kJ/mol.
24,27 kJ/mol.
7,5.
2,36 en la escala de Pauling.
139 pm
52.8 nΩ·m a 20ºC.
Se presenta predominantemente en la naturaleza como cinco isótopos: 182W, 183W, 184W, 186W y 180W. De acuerdo a la masa molar de 183 g/mol, la cual promedia las masas atómicas de estos isótopos (y los otros treinta radioisótopos), cada átomo de tungsteno o wolframio tiene alrededor de ciento diez neutrones (74 + 110 = 184).
Es un metal altamente resistente a la corrosión, pues su fina capa de WO3 lo protege contra el ataque del oxígeno, ácido y álcalis. Una vez disuelto y precipitado con otros reactivos, se obtienen sus sales, a las cuales se les llaman wolframatos o tungstatos; en ellas usualmente el tungsteno tiene un estado de oxidación de +6 (asumiendo que hay cationes W6+).
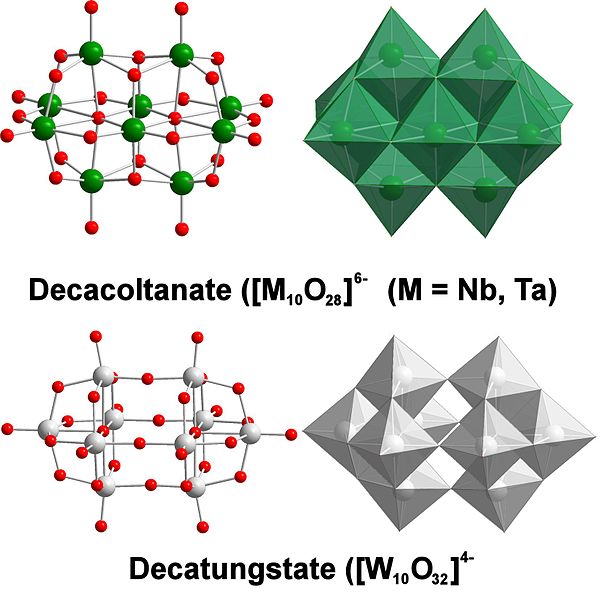
Químicamente el tungsteno es bastante particular porque sus iones tienden a agruparse (clustering, en inglés) para formar heteropoliácidos o polioxometalatos. ¿Qué son? Son grupos o clusters de átomos que se unen para definir un cuerpo tridimensional; principalmente, uno con estructura tipo jaula esférica, en la cual “encierran” otro átomo.
Todo empieza a partir del anión tungstato, WO42-, el cual en medio ácido rápidamente se protona (HWO4–) y se enlaza con un anión vecino para formar [W2O7(OH)2]2-; y este a su vez se une con otro [W2O7(OH)2]2- para originar el [W4O12(OH)4]4-. Así sucesivamente hasta que en solución haya varios politungstatos.
Los paratungstato A y B, [W7O24]6- y H2W12O4210-, respectivamente, son uno de los más resaltantes de estos polianiones.
Puede llegar a ser un desafío plantearse su bosquejo y estructuras de Lewis; pero basta en principio visualizarlos como conjuntos de octaedros WO6 (imagen superior).
Nótese que estos octaedros grisáceos terminan por definir el decatungstato, un politungstato; si en su interior encerrara un heteroátomo (por ejemplo, fósforo), se trataría entonces de un polioxometalato.
Los átomos de tungsteno definen un cristal con estructura cúbica centrada en el cuerpo (bcc, por body-centered cubic). A esta forma cristalina se le conoce como la fase α; mientras que la fase β también es cúbica, pero un poco más densa. Ambas fases o formas cristalinas, α y β, pueden coexistir en equilibrio en condiciones normales.
Los granos cristalinos de la fase α son isométricos, mientras que los de la fase β se asemejan columnas. Sin importar cómo sea el cristal, en este gobiernan los enlaces metálicos que mantienen fuertemente unidos los átomos W. De otro modo, no podría explicarse los altos puntos de fusión y ebullición, o la alta dureza y densidad del tungsteno.
Los átomos de tungsteno de algún modo tienen que estar muy unidos. Para enarbolar una conjetura, debe observarse antes la configuración electrónica de este metal:
[Xe]4f145d46s2
Los orbitales 5d son muy grandes y difuminados, lo que implicaría que entre dos átomos cercanos W haya solapamientos orbitales efectivos. Asimismo, los orbitales 6s contribuyen a las bandas resultantes, pero en menor grado. Mientras que los orbitales 4f se hayan “muy en el fondo” y su contribución por tanto al enlace metálico es menor.
Esto, el tamaño de los átomos, y los granos cristalinos, son las variables que determinan la dureza del tungsteno y su densidad.
En el tungsteno o wolframio metálico los átomos W tienen estado de oxidación cero (W0). Regresando a la configuración electrónica, los orbitales 5d y 6s pueden “vaciarse” de electrones dependiendo si W está en compañía de átomos muy electronegativos, como el oxígeno o flúor.
Cuando se pierden los dos electrones 6s, el tungsteno tiene estado de oxidación +2 (W2+), lo que genera que se contraiga su átomo.
Si pierde además todos los electrones de sus orbitales 5d, su estado de oxidación pasará a ser +6 (W6+); desde aquí no puede tornarse más positivo (en teoría), ya que los orbitales 4f por ser internos requerirían de grandes energías para remover sus electrones. Es decir que el estado de oxidación más positivo es +6, donde el tungsteno se haya más pequeño todavía.
Este tungsteno (VI) es muy estable en condiciones ácidas o en muchos compuestos oxigenados o halogenados. Otros estados de oxidación positivos y posibles son: +1, +2, +3, +4, +5 y +6.
El tungsteno también puede ganar electrones si se combina con átomos menos electronegativos que él. En este caso, se vuelven más grandes sus átomos. Puede llegar a ganar un máximo de cuatro electrones; es decir, tener un estado de oxidación de -4 (W4-).
Anteriormente se hizo mención de que el tungsteno se halla en los minerales wolframita y scheelita. Dependiendo del proceso, se obtienen de ellos dos compuestos: óxido de tungsteno, WO3, o paratungstato de amonio, (NH4)10(H2W12O42)·4H2O (o ATP). Cualquiera de ellos dos puede reducirse a W metálico con carbón por encima de los 1050ºC.
No es económicamente rentable producir lingotes de tungsteno, pues necesitarían de mucho calor (y dinero) para fundirlos. Es por eso que se prefiere producirlo en forma de polvo para de una vez tratarlo con otros metales para la obtención de aleaciones.
Cabe mencionar que a nivel mundial China es el país con la mayor producción de tungsteno. Y en el continente americano, Canadá, Bolivia y Brazil, ocupan también la lista de los mayores productores de este metal.

A continuación se mencionan algunos de los usos conocidos para este metal:
-Sus sales se llegaron a utilizar para colorear algodones de viejos atuendo de teatros.
-Combinado con el acero lo endurece todavía más, siendo capaz incluso de resistir cortes mecánicos a altas velocidades.
-Los filamentos de tungsteno sinterizado se ha utilizado desde hace más de cien años en las bombillas eléctricas y en las lámparas halogenadas. Asimismo, debido a su alto punto de fusión ha servido como material para tubos de rayos catódicos, y para las boquillas de los motores de cohetes.
-Reemplaza al plomo en la fabricación de los proyectiles y en escudos radiactivos.
-Los nanocables de tungsteno pueden utilizarse en nanodispositivos sensibles al pH y los gases.
-Catalizadores de tungsteno se utilizaron para lidiar con la producción de azufre en la industria petrolera.
-El carburo de tungsteno es de todos sus compuestos el que abarca más usos. Desde el fortalecimiento de herramientas de cortes y perforación, o la fabricación de piezas de armamentos militares, hasta para mecanizar maderas, plásticos y cerámicas.
Por ser un metal relativamente raro en la corteza terrestre, sus efectos negativos son escasos. En suelos ácidos, los politungstatos puede que no afecten las enzimas que utilicen los aniones molibdatos; pero en suelos básicos, el WO42- sí interviene (positiva o negativamente) en los procesos metabólicos del MoO42- y del cobre.
Las plantas, por ejemplo, pueden absorber los compuestos solubles de tungsteno, y al comerlas un animal y luego tras consumir su carne, los átomos de W ingresan a nuestros organismos. La mayoría son expulsados en la orina y heces, y poco se sabe qué sucede con el resto de ellos.
Estudios en animales demostraron que cuando inhalan altas concentraciones de tungsteno en polvo desarrollan síntomas parecidos a los de cáncer de pulmón.
Por ingestión, un humano adulto necesitaría beber miles de galones de agua enriquecida con sales de tungsteno para mostrar inhibición apreciable de las enzimas colinesterasa y fosfatasa.
En términos generales, el tungsteno es un elemento poco tóxico, y existen por lo tanto pocos riesgos entornos a daños en la salud.
Respecto al tungsteno metálico, debe evitarse respirar su polvo; y si la muestra es maciza, debe tenerse en mente que es muy densa y que puede ocasionar daños físicos si se cae o golpea otras superficies.
- Bell Terence. (s.f.). Tungsten (Wolfram): Properties, Production, Applications & Alloys. The balance. Recuperado de: thebalance.com
- Wikipedia. (2019). Tungsten. Recuperado de: en.wikipedia.org
- Lenntech B.V. (2019). Tungsten. Recuperado de: lenntech.com
- Jeff Desjardins. (01 de mayo de 2017). The History of Tungsten, the Strongest Natural Metal on Earth. Recuperado de: visualcapitalist.com
- Doug Stewart. (2019). Tungsten Element Facts. Recuperado de: chemicool.com
- Art Fisher y Pam Powell. (s.f.). Tungsten. University of Nevada. Recuperado de: unce.unr.edu
- Helmenstine, Anne Marie, Ph.D. (02 de marzo de 2019). Tungsten or Wolfram Facts. Recuperado de: thoughtco.com
