¿Qué es la configuración electrónica externa?
La configuración electrónica, también llamada estructura electrónica, es la disposición de electrones en niveles de energía alrededor de un núcleo atómico. Según el antiguo modelo atómico de Bohr, los electrones ocupan varios niveles en órbitas alrededor del núcleo, de la primera capa más cercana al núcleo, K, hasta la séptima capa, Q, que es la más alejada del núcleo.
En términos de un modelo mecánico cuántico más refinado, las capas K-Q se subdividen en un conjunto de orbitales, cada uno de los cuales puede ser ocupado por no más de un par de electrones.
Comúnmente, la configuración electrónica se utiliza para describir los orbitales de un átomo en su estado fundamental, pero también puede usarse para representar un átomo que se ha ionizado en un catión o anión, compensando con la pérdida o ganancia de electrones en sus respectivos orbitales.
Muchas de las propiedades físicas y químicas de los elementos pueden correlacionarse con sus configuraciones electrónicas únicas. Los electrones de valencia, los electrones en la capa más externa, son el factor determinante para la química única del elemento.
Conceptos básicos de las configuraciones electrónicas
Antes de asignar los electrones de un átomo a los orbitales, uno debe familiarizarse con los conceptos básicos de las configuraciones electrónicas. Cada elemento de la Tabla Periódica consiste en átomos, que están compuestos de protones, neutrones y electrones.
Los electrones exhiben una carga negativa y se encuentran alrededor del núcleo del átomo en los orbitales del electrón, definido como el volumen del espacio en el cual el electrón puede ser encontrado dentro del 95% de probabilidad.
Los cuatro tipos diferentes de orbitales (s, p, d, y f) tienen formas diferentes, y un orbital puede contener un máximo de dos electrones. Los orbitales p, d y f tienen subniveles diferentes, por lo que pueden contener más electrones.
Como se ha indicado, la configuración electrónica de cada elemento es única para su posición en la tabla periódica. El nivel de energía está determinado por el período y el número de electrones viene dado por el número atómico del elemento.
Orbitales en diferentes niveles de energía son similares entre sí, pero ocupan diferentes áreas en el espacio.
El orbital 1s y el orbital 2s tienen las características de un orbital s (nodos radiales, probabilidades de volumen esférico, sólo pueden contener dos electrones, etc.). Pero, como se encuentran en diferentes niveles de energía, ocupan diferentes espacios alrededor del núcleo. Cada orbital puede ser representado por bloques específicos en la tabla periódica.
El bloque s es la región de los metales alcalinos incluyendo el helio (Grupos 1 y 2), el bloque d son los metales de transición (Grupos 3 a 12), el bloque p son los elementos del grupo principal de los Grupos 13 a 18, Y el bloque f son las series de lantánidos y actínidos.
Principio de Aufbau
Aufbau proviene de la palabra alemana “Aufbauen” que significa “construir”. En esencia, al escribir configuraciones de electrones estamos construyendo orbitales de electrones a medida que avanzamos de un átomo a otro.
A medida que escribimos la configuración electrónica de un átomo, llenaremos los orbitales en orden creciente de número atómico.
El principio de Aufbau se origina en el principio de exclusión de Pauli que dice que no hay dos fermiones (por ejemplo, electrones) en un átomo. Pueden tener el mismo conjunto de números cuánticos, por lo que tienen que “acumularse” en niveles de energía más altos.
Cómo los electrones se acumulan es un tema de configuraciones de electrones (Aufbau Principle, 2015).
Los átomos estables tienen tantos electrones como hacen los protones en el núcleo. Los electrones se reúnen alrededor del núcleo en orbitales cuánticos siguiendo cuatro reglas básicas llamadas principio Aufbau.
- No hay dos electrones en el átomo que comparten los mismos cuatro números cuánticos n, l, m, y s.
- Los electrones ocuparán primero los orbitales del nivel de energía más bajo.
- Los electrones irán llenando los orbitales siempre con el mismo número de spin. Cuando los orbitales estén llenos comenzará.
- Los electrones llenarán orbitales por la suma de los números cuánticos n y l. Los orbitales con valores iguales de (n + l) se llenarán primero con los valores de n inferiores.
La segunda y cuarta reglas son básicamente las mismas. Un ejemplo de la regla cuatro sería los orbitales 2p y 3s.
Un orbital 2p es n = 2 y l = 2 y un orbital 3s es n = 3 y l = 1. (N + l) = 4 en ambos casos, pero el orbital 2p tiene la menor energía o menor valor n y se llenará antes de la capa 3s.
Afortunadamente, se puede usar el diagrama de Moeller mostrado para hacer el llenado de electrones. El gráfico se lee ejecutando las diagonales desde 1s.
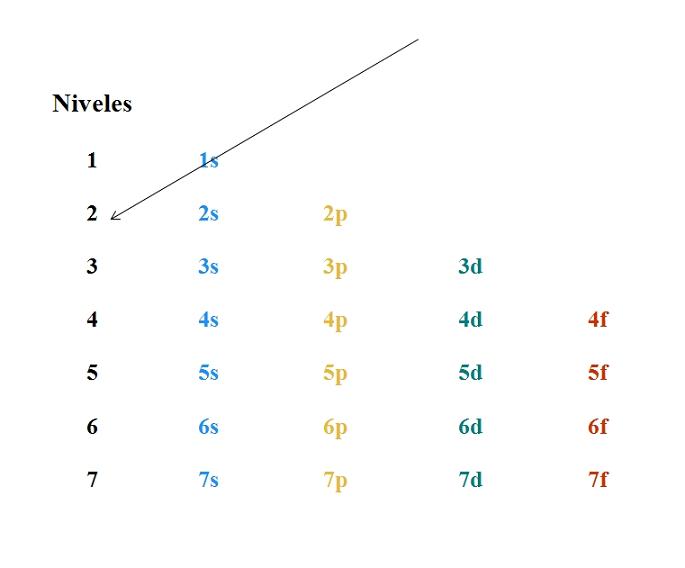
Ahora que se sabe que el orden de los orbitales se llena, lo único que queda es memorizar el tamaño de cada orbital.
S orbitales tienen 1 valor posible de ml para contener 2 electrones
P orbitales tienen 3 valores posibles de ml para contener 6 electrones
D orbitales tienen 5 valores posibles de ml para contener 10 electrones
F orbitales tienen 7 valores posibles de ml para contener 14 electrones
Esto es todo lo que se necesita para determinar la configuración electrónica de un átomo estable de un elemento.
Por ejemplo, tome el elemento nitrógeno. El nitrógeno tiene siete protones y por lo tanto siete electrones. El primer orbital a llenar es el orbital 1s.
Un orbital s tiene dos electrones, por lo que quedan cinco electrones. El orbital siguiente es el orbital 2s y contiene los dos siguientes. Los tres electrones finales irán al orbital 2p que puede contener hasta seis electrones (Helmenstine, 2017).
Importancia de la configuración electrónica externa
Las configuraciones de electrones juegan un papel importante en la determinación de las propiedades de los átomos.
Todos los átomos de un mismo grupo poseen la misma configuración electrónica externa con excepción del número atómico n, es por ello que poseen propiedades químicas similares.
Algunos de los factores clave que influyen en las propiedades atómicas incluyen el tamaño de los orbitales ocupados más grandes, la energía de los orbitales de mayor energía, el número de vacantes orbitales y el número de electrones en los orbitales de mayor energía.
La mayoría de las propiedades atómicas pueden estar relacionadas con el grado de atracción entre los electrones más externos al núcleo y el número de electrones en la capa de electrones más externa, el número de electrones de valencia.
Los electrones de la capa externa son los que pueden formar enlaces químicos covalentes, son los que tienen la capacidad de ionizarse para formar cationes o aniones y son los que le dan el estado de oxidación a los elementos químicos.
También determinarán el radio atómico. A medida de que n se hace más grande, el radio atómico aumenta. Cuando un átomo pierde un electrón, habrá una contracción del radio atómico debido a la disminución de carga negativa alrededor del núcleo.
Los electrones de la capa externa son los que son tomados en cuenta por la teoría del enlace de valencia, teoría del campo cristalino y teoría de orbital molecular para obtener las propiedades de las moléculas y las hibridaciones de los enlaces.
Referencias
- Aufbau Principle. (2015, Junio 3). Retrieved from chem.libretexts: chem.libretexts.org.
- Bozeman Science. (2013, Agoto 4). Electron Configuration. Tomado de youtube: youtube.com.
- Electron Configurations and the Properties of Atoms. (S.F.). Tomado de oneonta.edu: oneonta.edu.
- Encyclopædia Britannica. (2011, Septiembre 7). Electronic configuration. Tomado de britannica: britannica.com.
- Faizi, S. (2016, Julio 12). Electronic Configurations. Tomado de chem.libretexts: chem.libretexts.org.
- Helmenstine, T. (2017, Marzo 7). The Aufbau Principle – Electronic Structure and the Aufbau Principle. Tomado de thoughtco: thoughtco.com.
- Khan, S. (2014, Junio 8). Valence electrons and bonding. Tomado de khanacademy: khanacademy.org.
