Etanamida: estructura, propiedades, usos, efectos
La etanamida es una sustancia química que pertenece al grupo de los compuestos orgánicos nitrogenados. También recibe el nombre de acetamida, según la Unión Internacional de Química Pura y Aplicada (IUPAC por sus siglas en inglés). Comercialmente recibe el nombre de amida del ácido acético.
Se denomina amida porque el nitrógeno está unido a un grupo carbonilo. Es primaria, debido a que conserva los dos átomos de hidrógeno unidos al nitrógeno –NH2. Se ha encontrado en la naturaleza como mineral solo en tiempo seco; en época de lluvias o muy húmedas se disuelve en el agua.
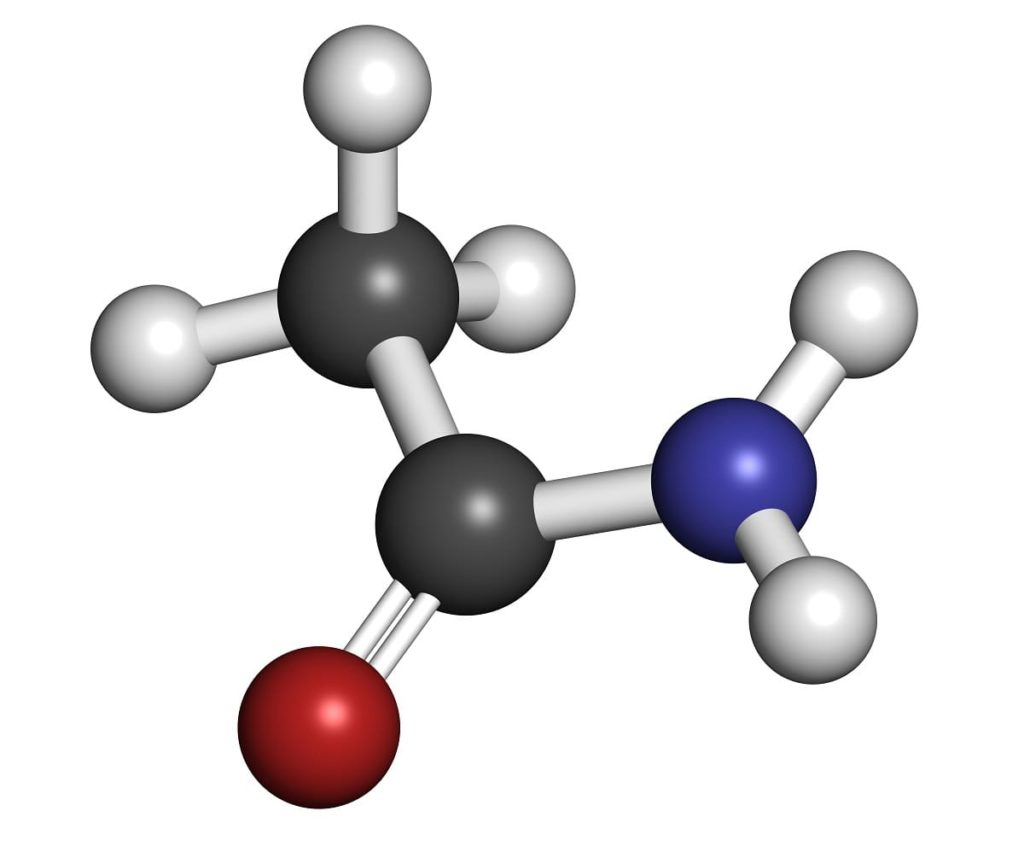
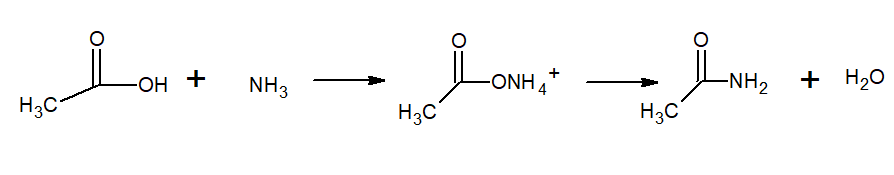
Es un sólido con aspecto vítreo (transparente). Su color va desde incoloro a gris, forma pequeñas estalactitas y a veces agregados granulares. Puede producirse por la reacción entre el ácido acético y el amoníaco, formando una sal intermedia: acetato de amonio. Luego esta es deshidratada para producir la amida y formar agua:
Índice del artículo
- 1 Estructura química
- 2 Propiedades físicas de la etanamida
- 3 Propiedades químicas
- 4 Usos de la acetamida
- 5 Efectos en la salud
- 6 Referencias
La estructura química interna del cristal de la acetamida es trigonal, pero al unirse entre sí para formar aglomerados adquiere una forma octaedral.
La fórmula estructural del compuesto consta de un grupo acetilo y de un grupo amino:
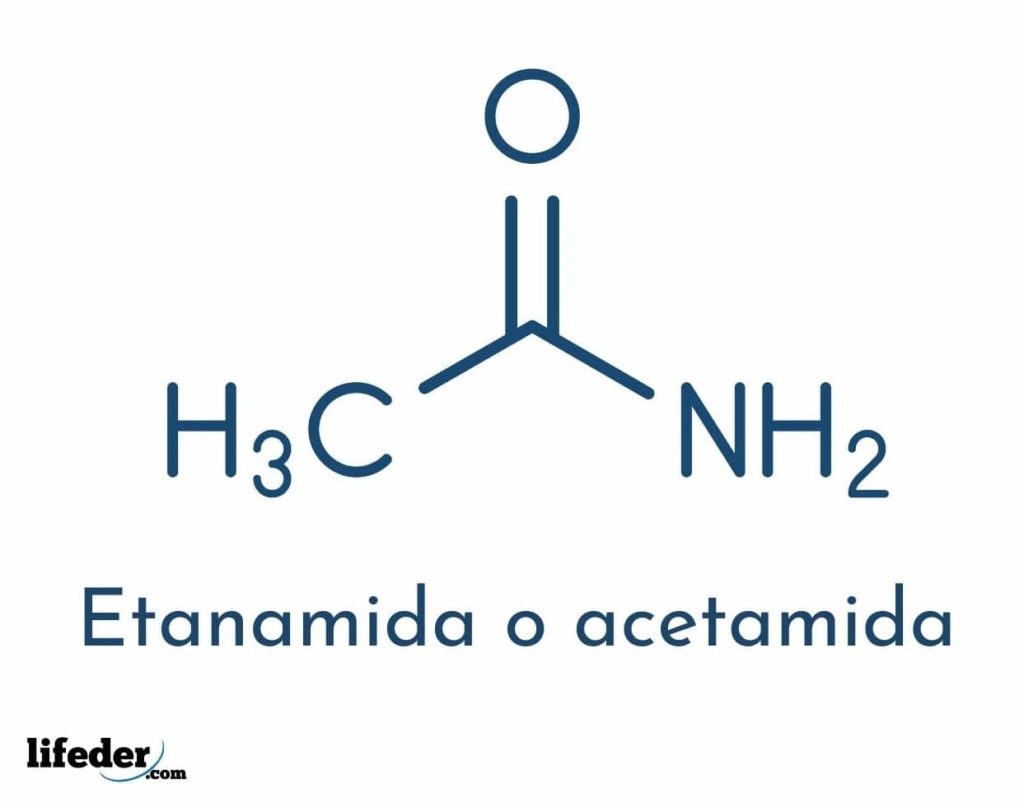
Estos grupos permiten que se lleven a cabo las diferentes reacciones que puede tener el compuesto. La fórmula molecular de la acetamida es C2H5NO.
Apariencia | Son cristales que van desde incoloros hasta grises. |
Olor | Inodoro. Cuando tiene impurezas tiene un olor a amoníaco-urea. |
Ocurrencia | Se puede encontrar en la naturaleza, además de las minas en las raíces de la remolacha azucarera, en el vino que se ha oxidado en exceso, y en el humo del tabaco. |
Masa molar | 59.07 g/mL |
Densidad del agua | 1.159 g/cm³ |
Punto de fusión | Entre un rango de 79°C-81°C |
Punto de ebullición | 221°C |
Solubilidad en agua, etanol, piridina, cloroformo, glicerol y benceno | Muy soluble |
Presión de vapor | 1.3x10-5 atm. |
Las propiedades químicas de una sustancia hacen alusión a su reactividad cuando están en presencia de otras que pueden causar transformación en su estructura. La acetamida presenta las siguientes reacciones:
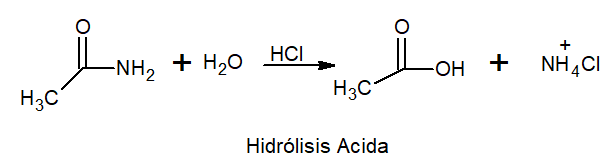
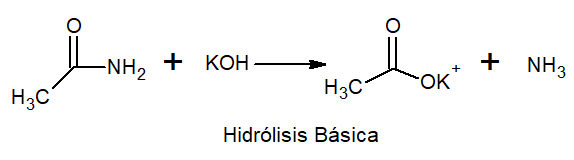
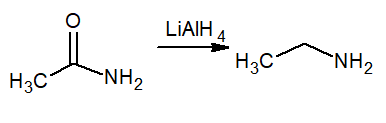
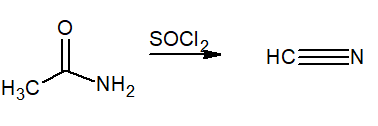
En el ámbito industrial la producción de ácidos carboxílicos es muy ventajosa por la importancia de sus derivados. Sin embargo, la obtención del ácido etanoico a partir de la acetamida posee una aplicación muy limitada, debido a que las elevadas temperaturas a las que ocurre el proceso tienden a descomponer el ácido.
En el laboratorio, si bien la etanamida se puede obtener a partir de del ácido acético, es muy poco probable la reconversión de una amida al ácido, y esto es en forma general para todas las amidas.
La acetamida se ha producido comercialmente desde 1920, aunque no es seguro que a la fecha esté en uso comercial. Anteriormente se usaba para la síntesis de metilaminas, tioacetamida, hipnóticos, insecticidas y con fines medicinales.
La acetamida es un compuesto que, en el ámbito industrial, se usa como:
- Plastificante, en cuero, películas de tela y recubrimientos.
- Aditivo para el papel, para dar resistencia y flexibilidad.
- Desnaturalización de alcoholes. Se agrega al alcohol en estudio para quitarle parte de la pureza que tenga y así pueda servir para otros usos, como por ejemplo, como disolvente.
- Laca, para dar brillo a las superficies y/o para proteger los materiales de las agresiones del medio, en especial de la corrosión.
- Explosivo.
- Fundente, dado que al ser agregada a una sustancia facilita la fusión de esta.
- En crioscopía.
- Como intermedio en la elaboración de medicamentos tales como ampicilina y antibióticos derivados de las cefalosporinas, tales como: cefaclor, cefalexina, cefradina, enalapril maleato (tratamiento de la hipertensión) y sulfacetamida (gotas oftálmicas antimicrobianas), entre otros.
- Solvente, dado que hace que algunas sustancias aumenten la solubilidad en agua cuando la acetamida es disuelta en ella.
- Como solvente que fija los colorantes en la industria textil.
- En la elaboración de metilaminas.
- Como biocida, en compuestos que pueden ser usados como desinfectantes, conservantes, plaguicidas, etc.
En las industrias químicas donde la acetamida es usada como solvente y plastificante, los trabajadores pueden presentar irritación en la piel debido a la exposición aguda (a corto plazo) por la presencia de estos compuestos.
No hay información sobre efectos crónicos (a largo plazo) o de desarrollo de carcinógenos en humanos. Según la Agencia de Protección Ambiental de Estados Unidos (EPA por sus siglas en inglés), la acetamida no está clasificada como carcinogénica.
La Agencia Internacional para la Investigación del Cáncer ha clasificado la acetamida como un Grupo 2B, posible carcinógeno humano.
La Agencia de Protección Ambiental de California ha establecido una estimación de riesgo por inhalación de 2×10-5 µg/m3 (microgramo por metro cúbico), y un riesgo de cáncer oral tras la ingestión de 7×10-2 mg/kg/d (miligramos por cada kilogramo en un día) por largo tiempo.
Sin embargo, aunque la población en general puede estar expuesta al fumar cigarrillos o al contacto de la piel con productos que contienen acetamida, no representa mucho riesgo debido a las características de solubilidad e higroscopia que tiene con el agua.
Se puede mover fácilmente por el suelo mediante las escorrentías, pero se espera que sea degradado por microorganismos y que no se acumule en los peces.
La acetamida es un leve irritante de la piel y de los ojos, y no hay datos disponibles que certifiquen sus efectos tóxicos en humanos.
En animales de laboratorio la toxicidad se observó en la pérdida de peso corporal al ser sometidos a una dosis oral muy alta a lo largo del tiempo. Sin embargo, no se observaron abortos ni efectos nocivos en el nacimiento de las crías de progenitores tratados con acetamida.
- Cosmos online, (desde 1995), Información Técnica y Comercial de la Acetamida, recuperado el 23 de marzo de 2018, cosmos.com.mx
- Morrison, R., Boyd, R., (1998), Química Orgánica (5° edición), México, Fondo Educativo Interamericano,S.A de C.V
- Pine, S., Hammond, G., Cram, D., Hendrickson, J., (1982). Química Orgánica, (segunda edición), México, McGraw-Hill de México, S.A de C.V
- Guía de productos químicos, (2013), Usos de la acetamida, recuperado el 24 de marzo de 2018, guiadeproductosquimicos.blogspot.com.co
- National Center for Biotechnology Information. PubChem Compound Database; CID=178, Acetamide. Recuperado pubchem.ncbi.nlm.nih.gov
