Éter etílico: qué es, estructura, propiedades, obtención, usos
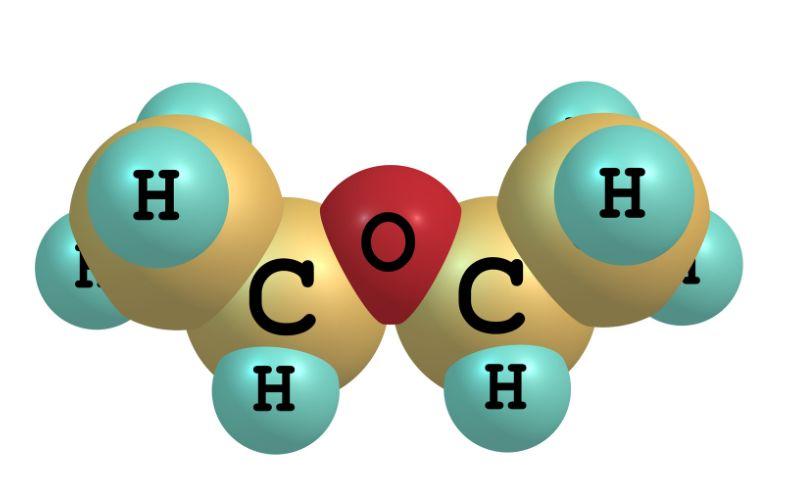
¿Qué es el éter etílico?
El éter etílico, también conocido como éter dietílico, es un compuesto orgánico cuya fórmula química es C4H10O. Se caracteriza por ser un líquido incoloro y volátil, y, por lo tanto, sus botellas deben mantenerse cerradas lo más herméticamente posible.
Este éter se clasifica como miembro de los éteres dialquílicos. Es decir, tienen la fórmula ROR’, donde R y R’ representan segmentos carbonados diferentes. Y tal como describe su segundo nombre, éter dietílico, son dos radicales –etil los que se enlazan al átomo de oxígeno.
Inicialmente, el éter etílico se usó como un anestésico general, introducido en 1846 por William Thomas Green Morton. Sin embargo, debido a su inflamabilidad, se desechó su uso, sustituyéndolo por otros anestésicos menos peligrosos.
Este compuesto también se ha empleado para calcular el tiempo de circulación de la sangre, durante la evaluación del estatus cardiovascular de pacientes.
Estructura del éter etílico
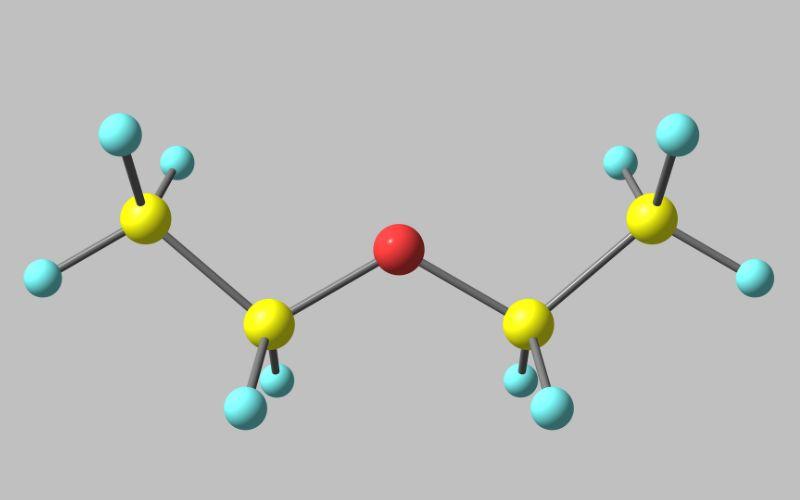
En la imagen superior se tiene una representación con un modelo de esferas y barras de la estructura molecular del éter etílico.
Como puede apreciarse, la esfera roja, correspondiente al átomo de oxígeno, posee dos grupos etilos enlazados a ambos lados. Todos los enlaces son sencillos, flexibles, y de libre rotación en torno a los ejes σ.
Estas rotaciones originan estereoisómeros conocidos como confórmeros, que más que isómeros, son estados espaciales alternativos. La estructura de la imagen corresponde exactamente al confórmero anti, en el que todos sus grupos de átomos se encuentran escalonados (apartados entre sí).
El otro confórmero está eclipsado, y aunque no esté su imagen disponible, basta con visualizarlo con forma de U. En los extremos superiores de la U se ubicarían los grupos metilos, –CH3, los cuales experimentarían repulsiones estéricas (chocarían en el espacio).
Por lo tanto, cabe esperar que la molécula de CH3CH2OCH2CH3 adopte la conformación anti la mayor parte del tiempo.
Propiedades físicas y químicas del éter etílico
Otros nombres
– Éter dietílico
– Etoxietano
– Etil óxido
Fórmula molecular
C4H10O o (C2H5)2O.
Peso molecular
74.14 g/mol.
Aspecto físico
Líquido incoloro.
Olor
Dulce y picante.
Sabor
Quemante y dulce.
Punto de ebullición
94.3 °F (34.6 °C) a 760 mm Hg.
Punto de fusión
-177.3 °F (-116.3 °C). Cristales estables.
Punto de ignición
-49 °F (recipiente cerrado).
Solubilidad en agua
6.04 g/100 mL a 25 °C.
Solubilidad en otros líquidos
Miscible con alcoholes alifáticos de cadena corta, benceno, cloroformo, éter de petróleo, solvente de grasas, muchos aceites y ácido clorhídrico concentrado.
Soluble en acetona y muy soluble en etanol. Asimismo es soluble en nafta, benceno y aceites.
Densidad
0.714 mg/mL a 68 °F (20 °C).
Densidad del vapor
2.55 (en relación con el aire tomado con densidad 1).
Presión de vapor
442 mm Hg a 68 °F. 538 mm Hg a 25 °C. 58,6 kPa a 20 °C.
Estabilidad
Es lentamente oxidado por la acción del aire, la humedad y la luz con formación de peróxidos.
La formación de peróxidos puede ocurrir en envases de éter que han sido abiertos y que permanecen en almacenamiento por más de seis meses. Los peróxidos pueden detonar por fricción, impacto o calentamiento.
Debe evitarse su contacto con: cinc, halógenos, oxihaluros no metálicos, agentes oxidantes fuertes, cloruro de cromilo, aceites de trementina, nitratos y cloruros metálicos.
Auto ignición
356 °F (180 °C).
Descomposición
Al calentarse se descompone, emitiendo un humo acre e irritante.
Viscosidad
0.2448 Poise a 20 °C.
Calor de combustión
8.807 Kcal/g.
Calor de vaporización
89.8 cal/g a 30 °C.
Tensión superficial
17.06 dinas/cm a 20 °C.
Potencial de ionización
9.53 eV.
Umbral de olor
0.83 ppm (la pureza no es dada).
Índice de refracción
1.355 a 15 °C.
Obtención del éter etílico
Se puede obtener éter etílico a partir de alcohol etílico, en presencia de ácido sulfúrico como catalizador. El ácido sulfúrico en un medio acuoso se disocia produciendo el ion hidronio, H3O+.
En el proceso contrario, es decir, la hidratación del etileno en fase de vapor, puede formarse éter etílico como un producto colateral además del alcohol etílico. De hecho, esta ruta sintética produce la mayor parte de este compuesto orgánico.
Toxicidad del éter etílico
Puede producir irritaciones en la piel y los ojos por contacto. El contacto con la piel puede producir su resecación y agrietamiento. El éter no suele penetrar la piel, ya que es rápidamente evaporado.
La irritación de los ojos causada por el éter suele ser leve, y en el caso de una irritación severa, los daños son generalmente reversibles.
Su ingestión produce efectos narcóticos e irritación estomacal. Una ingestión severa puede provocar daño renal.
La inhalación del éter puede ocasionar irritación de la nariz y garganta. En el caso de una inhalación de éter se puede producir: somnolencia, excitación, mareo, vómitos, respiración irregular y aumento de la salivación.
Una alta exposición puede causar pérdida del conocimiento e inclusive la muerte.
La OSHA establece un límite de exposición laboral en el aire de 800 ppm como promedio, durante un turno de 8 horas.
Niveles de irritación de los ojos: 100 ppm (humanos). Niveles de irritación de los ojos: 1200 mg/m3 (400 ppm).
Usos/aplicaciones del éter etílico
Solvente orgánico
Es un solvente orgánico que se utiliza para disolver bromo, yodo y otros halógenos. La mayoría de los lípidos (grasas), resinas, cauchos puros, algunos alcaloides, gomas, perfumes, acetato de celulosa, nitrato de celulosa, hidrocarburos y colorantes.
Además, se utiliza en la extracción de los principios activos de tejidos animales y plantas, debido a que tiene menor densidad que el agua y flota sobre ella, quedando las sustancias deseadas disueltas en el éter.
Anestesia general
Se ha usado como anestésico general desde 1840, sustituyendo al cloroformo por tener una ventaja terapéutica. Sin embargo, es una sustancia inflamable, y, por lo tanto, encuentra severas dificultades para su uso dentro de los ámbitos clínicos.
Además, produce en los pacientes algunos efectos secundarios postoperatorios indeseables, como náuseas y vómitos.
Por estas razones se ha desechado el empleo del éter como anestésico general, sustituyéndolo por otros anestésicos como el halotano.
Espíritu del éter
El éter mezclado con etanol se empleó para formar la solución llamada espíritu del éter, usada en el tratamiento de la flatulencia gástrica y formas más leves de gastralgia.
Evaluación de la circulación sanguínea
El éter ha sido utilizado para evaluar la circulación sanguínea entre un brazo y los pulmones. Se inyecta el éter en un brazo, llevándolo la sangre a la aurícula derecha, luego al ventrículo derecho y de allí a los pulmones.
El tiempo que transcurre desde la inyección del éter, hasta la captación del olor del éter en el aire espirado, es de aproximadamente de 4 a 6 s.
Laboratorios de docencia
El éter se utiliza en los laboratorios de docencia en muchos experimentos. Por ejemplo, en la demostración de las leyes de Mendel de la genética.
Se usa el éter para adormecer las moscas del género Drosophila y permitir los cruces necesarios entre ellas, para poner así en evidencia las leyes de la genética.
Referencias
- Graham Solomons T.W., Craig B. Fryhle. Organic Chemistry. Amines. Wiley Plus.
- Ethyl ether. Recuperado de britannica.com
