Nitrobenceno (C6H5NO2): estructura, propiedades, usos, riesgos
El nitrobenceno es un compuesto orgánico aromático formado por un anillo bencénico C6H5– y un grupo nitro –NO2. Su fórmula química es C6H5NO2. Es un líquido aceitoso incoloro o amarillo pálido, con olor a almendras amargas o a pulimento para zapatos.
El nitrobenceno es un compuesto muy útil en la industria química porque permite obtener una serie de sustancias químicas que poseen variados usos. Esto se debe a que puede ser sometido a diversos tipos de reacciones.
Entre las reacciones químicas importantes están la nitración (que permite añadir más grupos –NO2 a la molécula) y la reducción (lo contrario de oxidación pues se eliminan los dos átomos de oxígeno del grupo nitro –NO2 y se sustituyen por hidrógenos).
Con el nitrobenceno se puede preparar por ejemplo anilina y para-acetaminofenol. Este último es el conocido acetaminofén que es un antipirético (medicamento contra la fiebre) y analgésico suave (medicamento contra dolores leves).
El nitrobenceno debe manipularse con precaución pues es irritante y tóxico, puede causar un tipo de anemia, entre varios síntomas, y se cree que puede causar cáncer. Además es dañino para el medio ambiente.
Índice del artículo
- 1 Estructura
- 2 Nomenclatura
- 3 Propiedades
- 4 Obtención
- 5 Usos
- 6 Riesgos
- 7 Tratamientos para su eliminación del ambiente
- 8 Referencias
El nitrobenceno C6H5–NO2 es una molécula plana formada por un anillo bencénico C6H5– al cual está unido un grupo nitro –NO2. Su molécula es plana porque hay una interacción electrónica entre el grupo nitro –NO2 y el anillo bencénico.
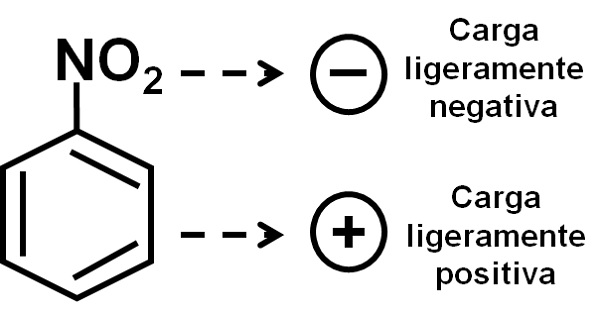
El grupo nitro –NO2 tiende a atraer los electrones del anillo bencénico C6H5–.
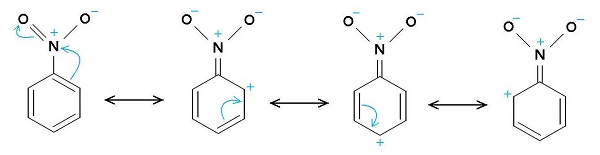
Por ello la molécula tiene un lado ligeramente más negativo (donde están los oxígenos del –NO2) y un lado ligeramente más positivo (el anillo bencénico).
– Nitrobenceno.
– Nitrobencina.
– Nitrobenzol.
– Aceite o esencia de mirbano o de mirbana (término en desuso).
Líquido aceitoso incoloro a amarillo pálido.
123,11 g/mol.
5,7 ºC.
211 ºC.
88 ºC (método de copa cerrada).
480 °C.
1,2037 g/cm3 a 20 ºC.
Poco soluble en agua: 0,19 g/100 g de agua a 20 °C. Completamente miscible con alcohol, benceno y éter dietílico.
El nitrobenceno es estable hasta aproximadamente unos 450 °C temperatura en la que empieza a descomponerse formando (en ausencia de oxígeno) NO, NO2, benceno, bifenilo, anilina, dibenzofurano y naftaleno.
Entre las reacciones importantes del nitrobenceno se destacan la reducción, la nitración, la halogenación y la sulfonación.
La nitración del nitrobenceno produce inicialmente meta-nitrobenceno y con un tiempo prolongado de reacción se obtiene el 1,3,5-nitrobenceno.
Haciendo reaccionar bromo o cloro con nitrobenceno en presencia de un catalizador apropiado se obtiene el 3-bromo-nitrobenceno (meta-bromonitrobenceno) o el 3-cloro-nitrobenceno (meta-cloronitrobenceno).
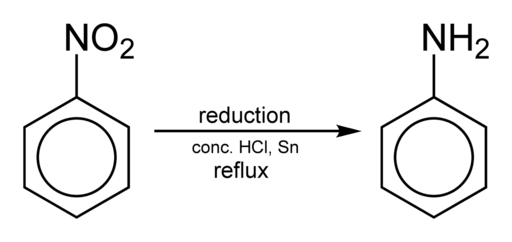
Un ejemplo de reducción es que al tratar con estaño (Sn) en ácido clorhídrico (HCl) los meta-halogenonitrobencenos se obtienen las meta-halogenoanilinas.
La sulfonación del nitrobenceno se realiza con ácido sulfúrico fumante a 70-80 °C y el producto es ácido meta-nitrobencenosulfónico. Este se puede reducir con hierro y HCl para dar ácido metanílico.
En una solución de benceno C6H6 las moléculas de nitrobenceno se asocian entre sí formando dímeros o pares de moléculas. En estos pares una de las moléculas se encuentra en posición invertida respecto a la otra.
La formación de dímeros de nitrobenceno con moléculas una en posición invertida respecto a la otra se debe posiblemente a que cada una de ellas tiene un lado con carga ligeramente más positiva y un lado opuesto con carga ligeramente más negativa.
En el dímero el lado con carga ligeramente más positiva de una de las moléculas posiblemente se ubica cercano a la carga ligeramente negativa de la otra molécula, pues las cargas opuestas se atraen, y así ocurre con los otros dos lados.
Presenta un olor similar a almendras o a pulimento para zapatos. Al bajar su temperatura solidifica en forma de cristales amarillo verdosos.
Se obtiene tratando el benceno C6H6 con una mezcla de ácido nítrico HNO3 y ácido sulfúrico H2SO4. El proceso se llama nitración e involucra la formación del ion nitronio NO2+ gracias a la presencia del ácido sulfúrico H2SO4.
– Formación del ion nitronio NO2+:
HNO3 + 2 H2SO4 ⇔ H3O+ + 2 HSO4– + NO2+ (ion nitronio)
– El ion nitronio ataca al benceno:
C6H6 + NO2+ → C6H6NO2+
– Se forma el nitrobenceno:
C6H6NO2+ + HSO4– → C6H5NO2 + H2SO4
En resumen:
C6H6 + HNO3 → C6H5NO2 + H2O
La reacción de nitración del benceno es muy exotérmica, es decir, se genera mucho calor, por lo que es muy peligrosa.
El nitrobenceno se utiliza principalmente para sintetizar anilina C6H5NH2, que es un compuesto muy utilizado para la preparación de pesticidas, gomas, colorantes, explosivos y medicamentos.
La obtención de anilina ocurre mediante la reducción del nitrobenceno en medio ácido en presencia de hierro o estaño, la cual se realiza según los siguientes pasos:
Nitrobenceno → Nitrosobenceno → Fenilhidroxilamina → Anilina
C6H5NO2 → C6H5NO → C6H5NHOH → C6H5NH2
Dependiendo de las condiciones, el proceso se puede detener en uno de los pasos intermedios por ejemplo en la fenilhidroxilamina. Partiendo de la fenilhidroxilamina en medio fuertemente ácido se puede preparar para-aminofenol:
Fenilhdroxilamina → p-Aminofenol
C6H5NHOH → HOC6H4NH2
Este último se trata con anhídrido acético para obtener paracetamol (acetaminofén) un conocido antipirético y analgésico suave, esto es, un medicamento para tratar la fiebre y dolores.
Otra forma de obtener la anilina es mediante la reducción del nitrobenceno con monóxido de carbono (CO) en medio acuoso en presencia de partículas muy pequeñas (nanopartículas) de paladio (Pd) como catalizador.
C6H5–NO2 + 3 CO + H2O → C6H5–NH2 + 3 CO2
El nitrobenceno es el punto de partida para obtener una gran variedad de compuestos usados como colorantes, pesticidas, medicamentos y cosméticos.

Por ejemplo, permite obtener el 1,3-dinitrobenceno que por cloración (adición de cloro) y reducción (eliminación de los átomos de oxígeno) genera 3-cloroanilina. Esta se usa como intermediario para pesticidas, colorantes y medicinas.
El nitrobenceno se utilizaba para preparar bencidina que es un colorante. Además el nitrobenceno sirve para preparar quinolina, azobenceno, ácido metanilico, dinitrobenceno, isocianatos o piroxilina entre muchos otros compuestos.
El nitrobenceno se emplea o se ha empleado como:
– Solvente de extracción para la purificación de aceites lubricantes usados en maquinarias
– Solvente para éteres de celulosa
– Ingrediente de mezclas para pulir metales
– En jabones
– En mezclas para pulir zapatos
– Conservante de pinturas en spray
– Componente de mezclas para pulido de pisos
– Sustituto de esencia de almendras
– En la industria de los perfumes
– En la producción de goma sintética
– Solvente en diversos procesos

El nitrobenceno es tóxico por inhalación, ingestión y absorción a través de la piel.
Irrita la piel, los ojos y el tracto respiratorio. Puede causar un tipo de anemia llamada metahemoglobinemia que consiste en la reducción de la capacidad de los glóbulos rojos de liberar oxígeno en los tejidos y genera fatiga.
Además el nitrobenceno causa disnea, mareo, visión trastornada, falta de aliento, colapso y muerte. También daña el hígado, bazo, riñones y sistema nervioso central.
Se estima que puede ser un mutágeno y posiblemente causante de cáncer en humanos, pues lo ha causado en animales.
Adicionalmente el nitrobenceno no debería ser desechado en el ambiente. Su toxicidad hacia los animales, plantas y microorganismos hace que sea muy dañino para los ecosistemas.
La toxicidad hacia los microorganismos disminuye su biodegradabilidad.
La contaminación del ambiente con nitrobenceno puede ocurrir a través de los desechos de las diversas industrias que lo emplean, como por ejemplo la industria de los colorantes o la de los explosivos.
El nitrobenceno es un contaminante altamente tóxico y difícil de descomponer bajo condiciones naturales, por esta razón puede causar contaminación severa de aguas potables y sistemas de irrigación de sembradíos.
Por su alta estabilidad y toxicidad hacia los microorganismos muchas veces es seleccionado como modelo en estudios de tratamiento de aguas servidas.
Se están investigando diversas formas de eliminar al nitrobenceno de agua contaminada. Una de ellas es a través de la degradación fotocatalítica, esto es, utilizando luz solar como acelerador de la reacción de degradación en presencia de dióxido de titanio TiO2.

También se han probado con éxito métodos de microelectrólisis con un catalizador de hierro (Fe) y cobre (Cu) en cerámica. La microelectrólisis permite descomponer el nitrobenceno mediante una corriente eléctrica.
- U.S. National Library of Medicine. (2019). Nitrobenzene. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Morrison, R.T. and Boyd, R.N. (2002). Organic Chemistry. 6th Edition. Prentice-Hall.
- Moldoveanu, S.C. (2019). Pyrolysis of Other Nitrogen-Containing Compounds. In Pyrolysis of Organic Molecules (Second Edition). Recuperado de sciencedirect.com.
- Smith, P.W.G. et al. (1969). Aromatic nitration-Nitro compounds. Electrophilic Substitutions. In Aromatic Chemistry. Recuperado de sciencedirect.com.
- Windholz, M. et al. (editors) (1983). The Merck Index. An Encyclopedia of Chemicals, Drugs, and Biologicals. Tenth Edition. Merck & CO., Inc.
- Ullmann’s Encyclopedia of Industrial Chemistry. (1990). Fifth Edition. Volume A22. VCH Verlagsgesellschaft mbH.
- Whang, T.-J. et al. (2012). UV-Irradiated Photocatalytic Degradation of Nitrobenzene by Titania Binding on Quartz Tube. International Journal of Photoenergy, Volume 2012, Article ID 681941. Recuperado de hindawi.com.
- Shikata, T. et al. (2014). Nitrobenzene anti-parallel dimer formation in non-polar solvents. AIP Advances 4, 067130 (2014). Recuperado de doaj.org.
- Krogul-Sobczak, A. et al. (2019). Reduction of Nitrobenzene to Aniline by CO/H2O in the Presence of Palladium Nanoparticles. Catalysts 2019, 9, 404. Recuperado de mdpi.com.
- Yang, B. et al. (2019). Pilot-Scale Production, Properties and Application of Fe/Cu Catalytic-Ceramic-Filler for Nitrobenzene Compounds Wastewater Treatment. Catalysts 2019, 9, 11. Recuperado de mdpi.com.
