Hidruro de aluminio (AlH3): estructura, propiedades, usos
El hidruro de aluminio es un compuesto inorgánico cuya fórmula química es AlH3. Aunque parezca de naturaleza simple, en realidad se trata de una sustancia un tanto intrincada. A causa del brillo cristalino que puede presentarse en su sólido, suele tomarse como un hidruro iónico, formado por iones Al3+ y H–.
No obstante, sus propiedades demuestran lo contrario: es un sólido polimérico, cuya representación más fiel vendría a ser del tipo (AlH3)n, siendo n el número de unidades monoméricas AlH3 que integraría una cadena o capa del cristal. Por lo tanto, el AlH3 es uno de esos polímeros que logra adoptar una estructura cristalina.
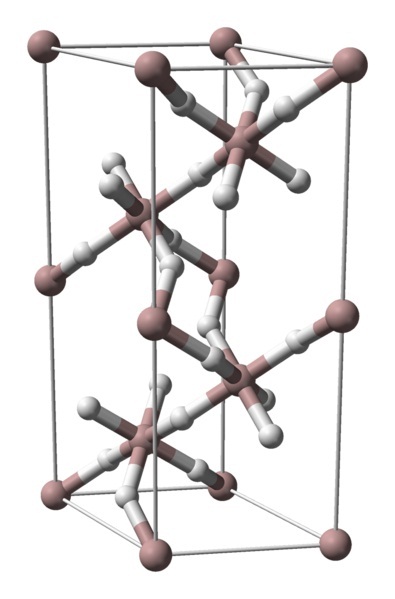
El hidruro de aluminio no es un sólido con mucha difusión comercial, por lo que son escasas las imágenes disponibles que se tienen de él. Se destina especialmente para síntesis orgánicas, donde sirve como un poderoso agente reductor. Asimismo, ocupa un lugar especial en el avance tecnológico de materiales, siendo una alternativa prometedora para el almacenaje de hidrógeno.
Este compuesto, también llamado alano, guarda una estrecha relación con el LiAlH4, cuyos nombres son hidruro de aluminio y litio, alanato de litio, o tetrahidroaluminato de litio. A pesar de que posee características de polímero y una metaestabilidad térmica, se presenta en siete polimorfos con distintas morfologías cristalinas.
Índice del artículo
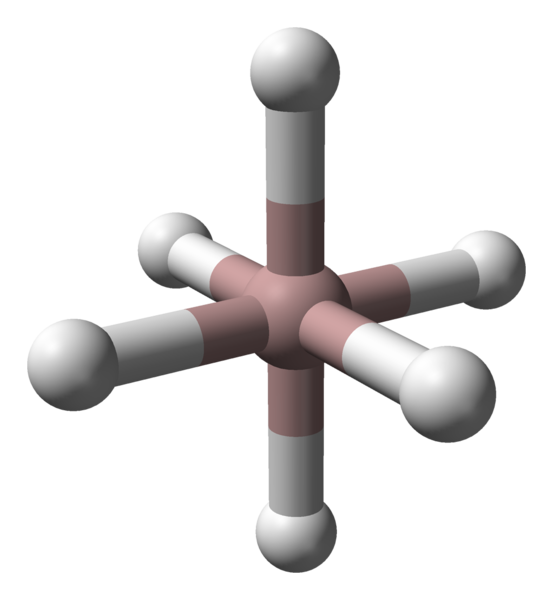
Independientemente de cuál sea el polimorfo o la fase cristalina considerada, las coordinaciones entre los átomos de aluminio e hidrógeno se mantienen constantes. En la imagen superior, por ejemplo, al igual que como en la primera imagen, se muestra el octaedro de coordinación para los átomos de aluminio (esfera marrón).
Cada átomo Al se encuentra rodeado de seis H, estableciéndose seis enlaces Al-H. El modo en cómo se orientan los octaedros en el espacio marcará la diferencia estructural entre un polimorfo y otro.
Por otro lado, cada átomo H se coordina con dos átomos Al, estableciéndose un enlace Al-H-Al, que podría justificarse mediante un enlace de tipo 3c2e (3centros-2 electrones). Este enlace es el responsable de unir varios octaedros AlH6 a lo largo y ancho del cristal de alano.
El AlH3 se considera polimérico a causa de las redes AlH6 que integran el cristal. Para aislar una molécula individual de alano, es necesario aplicar bajas presiones en una atmósfera inerte de gas noble. De esta manera, el polímero se quiebra y libera moléculas AlH3 de geometría plano trigonal (análogas al BH3).
Por otra parte, es posible dimerizar dos AlH3 para formar un Al2H6, tal como sucede con el diborano, B2H6. Sin embargo, para lograrlo se requiere del uso de hidrógeno sólido, por lo que posiblemente no tenga mucho valor industrial o comercial a largo plazo.
El alano o AlH3 es capaz de formar hasta siete polimorfos: α, α’, β, γ, δ, ε y ζ, de los cuales el α es el más estable ante cambios de temperatura. El α-AlH3 se distingue por tener una morfología cúbica y una estructura cristalina hexagonal. Tiende a ser el producto en que se transforman los otros polimorfos cuando sufren desestabilización térmica.
La morfología del γ-AlH3, por otra parte, sobresale por ser de tipo agujas. Es por eso que el AlH3 sólido puede contener una mezcla de más de dos polimorfos, y presentar cristales variados al microscopio.
El hidruro de aluminio es un sólido incoloro o blanquecino, de apariencia cristalina con tendencia a mostrar formas de agujas.
29.99 g/mol o 30 g/mol
150 ºC. Pero comienza a descomponerse a partir de los 105 ºC.
Alta, pues reacciona con ella.
Insoluble en dietiléter y en solventes apolares como benceno y pentano. Reacciona con los alcoholes y otros solventes polares.
El AlH3 es susceptible a descomponerse a distintas velocidades dependiendo de las condiciones externas, de la morfología y estabilidades térmicas de sus cristales, o del uso de catalizadores. Cuando lo hace, libera hidrógeno y se transforma en aluminio metálico:
2AlH3 → 2Al + 3H2
De hecho, esta descomposición más que ser un problema, representa una de las razones por las que el alano se considera interesante en el desarrollo de nuevas tecnologías energéticas.
Cuando el AlH3 no reacciona con el solvente de manera irreversible, establece un aducto con él, es decir, un tipo de complejo. Por ejemplo, puede formar un complejo con la trimetilamina, AlH3·2N(CH3)3, con el tetrahidrofurano, AlH3·THF, o con el dietileter, AlH3·Et2O. Este último fue el más conocido cuando se introdujo la síntesis u obtención del alano en 1947.
Las primeras apariciones del AlH3 se remontan a los años 1942 y 1947, siendo este último año cuando se presentó su síntesis utilizando LiAlH4 en un medio de dietiléter:
3LiAlH4 + AlCl3+ nEt2O → 4AlH3 · nEt2O + 3LiCl
La solución etérea, AlH3 · nEt2O, debía posteriormente someterse a desolvatación, con el propósito de eliminar el Et2O y obtener el AlH3 puro. Además de este problema, se debía eliminar el LiCl del medio de los productos.
Así, desde 1950 hasta 1977, fueron diseñándose nuevas síntesis para obtener mejores rendimientos de AlH3, así como sólidos más puros y de mejores propiedades térmicas y morfológicas. Modificando las cantidades, los pasos y los instrumentos utilizados, es posible favorecer la obtención de un polimorfo por encima del otro. Sin embargo, el α-AlH3 suele ser el producto mayoritario.
Otros métodos de síntesis consisten de hacer uso de la electroquímica. Para ello, se utiliza un ánodo de aluminio y un cátodo de platino. En el ánodo transcurre la siguiente reacción:
3AlH4− + Al3+ + nTHF → 4AlH3 · nTHF + 3e−
Mientras que en el cátodo se obtiene sodio metálico. Luego, el AlH3 · nTHF se somete también a desolvatación para eliminar el THF y obtener finalmente el AlH3.
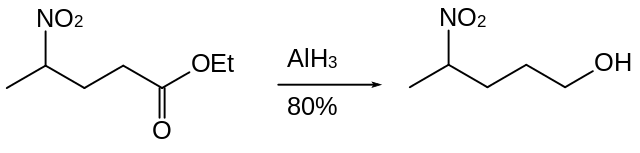
El AlH3 sirve para reducir ciertos grupos funcionales de compuestos orgánicos tales como ácidos carboxílicos, cetonas, aldehídos y esteres. Prácticamente, lo que hace es adicionar hidrógenos. Por ejemplo, un ester puede ser reducido a un alcohol en presencia de un grupo nitro:
El hidruro de aluminio representa una alternativa para servir como reservorio de hidrógeno, y así, poder dispensarlo de manera portátil en dispositivos que operan con baterías de hidrógeno. Los volúmenes obtenidos de H2 corresponden a un volumen mayor del doble que del AlH3.
Teniendo el AlH3, y descomponiéndolo controladamente, se puede liberar cierta cantidad deseable de H2 en cualquier momento. Por lo tanto, podría usarse como combustible para cohetes y todas aquellas aplicaciones energéticas que busquen aprovechar la combustión del hidrógeno.
- Shiver & Atkins. (2008). Química Inorgánica. (cuarta edición). Mc Graw Hill.
- Wikipedia. (2020). Aluminium hydride. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. (2020). Aluminum hydride. PubChem Database., CID=14488. Recuperado de: pubchem.ncbi.nlm.nih.gov
- J. Graetz et al. (2011). Aluminum hydride as a hydrogen and energy storage material: Past, present and future. Elsevier B.V.
- Xu Bo et al. (2014). Preparation and thermal properties of aluminum hydride polymorphs. doi.org/10.1016/j.vacuum.2013.05.009
