Óxido de mercurio (Hg2O): qué es, estructura, propiedades, usos
¿Qué es el óxido de mercurio?
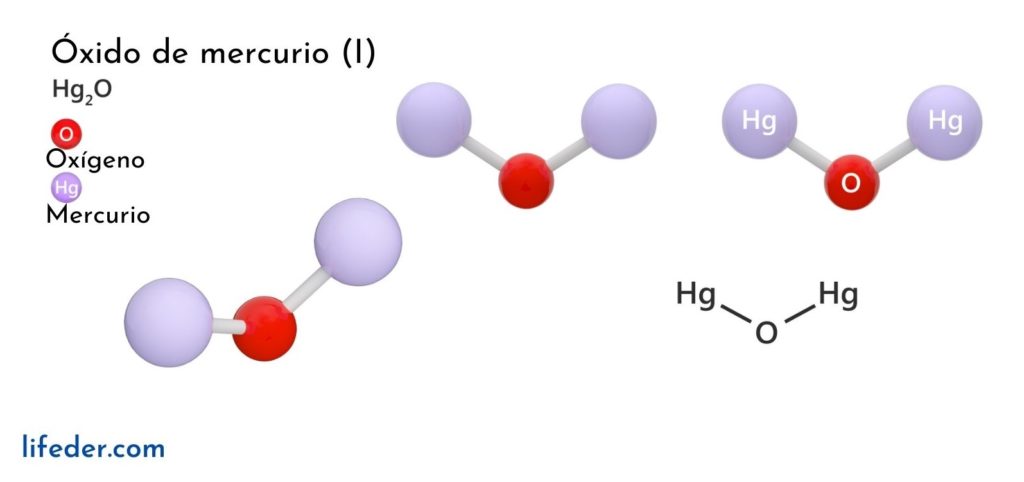
El óxido de mercurio (I) u óxido férrico, cuya fórmula química se representa como Hg2O, es un compuesto en fase sólida, considerado como tóxico e inestable desde el punto de vista químico, transformándose en mercurio en su forma elemental y óxido de mercurio (II).
Existen solo dos especies químicas que puede formar el mercurio al combinarse con el oxígeno, porque este metal tiene dos únicos estados de oxidación (Hg+ y Hg2+): óxido de mercurio (I) y óxido de mercurio (II). El óxido de mercurio (II) se encuentra en estado de agregación sólido, obteniéndose en dos formas cristalinas relativamente estables.
Este compuesto también se conoce simplemente como óxido de mercurio, por lo cual solo esta especie se tratará de aquí en adelante. Una reacción muy común que ocurre con esta sustancia es que, al ser sometido a calentamiento, ocurre su descomposición, produciendo mercurio y oxígeno gaseoso en un proceso endotérmico.
Estructura química
En condiciones de presión atmosférica, esta especie se presenta en dos únicas formas cristalinas: una denominada cinabrio y otra conocida como montrodita, la cual se encuentra muy raramente. Ambas formas se transforman en tetragonales por encima de los 10 GPa de presión.
La estructura del cinabrio está basada en celdas hexagonales primitivas (hP6) con simetría trigonal, cuyo eje helicoidal está orientado hacia la izquierda (P3221); en cambio, la estructura de la montrodita es ortorrómbica, basada en una retícula primitiva que forma planos de deslizamiento perpendiculares a los tres ejes (Pnma).
En contraste, se pueden distinguir visualmente dos formas del óxido de mercurio, debido a que una es roja y la otra amarilla. Esta distinción en el color se produce gracias a las dimensiones de la partícula, debido a que las dos formas poseen la misma estructura.
Para producir la forma roja del óxido de mercurio puede recurrirse al calentamiento de mercurio metálico en presencia de oxígeno a una temperatura alrededor de 350 °C, o al proceso de pirólisis del nitrato de mercurio (II) (Hg(NO3)2).
Del mismo modo, para producir la forma amarilla de este óxido puede recurrirse a la precipitación del ion Hg2+ en forma acuosa con una base.
Propiedades del óxido de mercurio
– Posee un punto de fusión de aproximadamente 500 °C (equivalente a 773 K), por encima del cual sufre descomposición, y una masa molar o peso molecular de 216,59 g/mol.
– Se encuentra en estado de agregación sólido en diferentes colores: naranja, rojo o amarillo, de acuerdo con el grado de dispersión.
– Es un óxido de naturaleza inorgánica, cuya proporción con el oxígeno es 1:1, lo cual lo convierte en una especie binaria.
– Se considera insoluble en amoníaco, acetona, éter y alcohol, así como en otros solventes de naturaleza orgánica.
– Su solubilidad en agua es muy baja, siendo de aproximadamente 0,0053 g/100ml a temperatura estándar (25 °C) e incrementándose con el aumento de la temperatura.
– Se considera soluble en la mayor parte de los ácidos; sin embargo, la forma amarilla muestra mayor reactividad y mayor capacidad de disolución.
– Cuando se expone el óxido de mercurio al aire sufre de descomposición, mientras que su forma roja lo hace al exponerse a fuentes de luz.
– Al ser sometido a calentamiento hasta la temperatura en la cual se descompone, libera gases de mercurio de elevada toxicidad.
– Solo cuando es calentado hasta 300-350 °C el mercurio puede combinarse con el oxígeno a una tasa rentable.
Usos/aplicaciones
Se utiliza como precursor en la obtención de mercurio elemental, debido a que sufre procesos de descomposición de manera bastante fácil; a su vez, al descomponerse produce oxígeno en su forma gaseosa.
De manera similar, este óxido de naturaleza inorgánica se utiliza como agente valorante o de titulación de tipo estándar para especies aniónicas, debido a que se genera un compuesto que presenta mayor estabilidad que su forma inicial.
En este sentido, el óxido de mercurio experimenta disolución cuando se encuentra en soluciones concentradas de especies básicas, produciendo compuestos denominados hidroxocomplejos.
Estos compuestos son complejos con estructura Mx(OH)y, donde M representa un átomo metálico y los subíndices x y y representan el número de veces que se halla esa especie en la molécula. Son de enorme utilidad en investigaciones químicas.
Además, el óxido de mercurio (II) puede ser empleado en los laboratorios para la producción de diferentes sales del metal; por ejemplo, el acetato de mercurio (II), el cual se emplea en procesos de síntesis de tipo orgánico.
También se utiliza este compuesto, al mezclarse con grafito, como material para el electrodo catódico en la producción de baterías de mercurio y celdas de tipo eléctrico de óxido de mercurio y zinc.
Riesgos
– Esta sustancia, que manifiesta características básicas de manera muy débil, es un reactivo muy útil para diversas aplicaciones como las que se mencionan previamente, pero a su vez presenta riesgos importantes para el ser humano cuando se expone a este.
– El óxido de mercurio presenta elevada toxicidad, pudiendo ser absorbido por las vías respiratorias, puesto que desprende gases irritantes cuando se encuentra en forma de aerosol, además de ser sumamente tóxico si llega a ser ingerido o si es absorbido por la piel al entrar en contacto directo con esta.
– Este compuesto produce irritación de los ojos y puede ocasionar daño en los riñones que derive posteriormente en problemas de insuficiencia renal.
– Cuando es consumida de una u otra manera por especies acuáticas, esta sustancia química se bioacumula en estas y afecta al organismo de los seres humanos que regularmente las consumen.
– El calentamiento del óxido de mercurio origina vapores de mercurio que poseen elevada toxicidad además de oxígeno gaseoso, incrementando así el riesgo de inflamabilidad; es decir, de producir incendios y de mejorar la combustión en estos.
– Este óxido inorgánico posee un poderoso comportamiento oxidante, por lo cual produce reacciones violentas al entrar en contacto con agentes reductores y ciertas sustancias químicas como cloruro de azufre (Cl2S2), peróxido de hidrógeno (H2O2), cloro y magnesio (solo cuando es calentado).
