Nitrato de plomo: estructura, propiedades, obtención, usos
El nitrato de plomo o nitrato de plomo (II) es un compuesto inorgánico formado por los elementos plomo (Pb), nitrógeno (N) y oxígeno (O). El plomo se encuentra como ion Pb2+ y el nitrógeno y oxígeno forman el ion nitrato NO3–.
Su fórmula química es Pb(NO3)2. Es un sólido cristalino blanco muy soluble en agua, en donde forma los iones Pb2+ y NO3–. También se le conoce como nitrato plumboso porque el plomo se encuentra en su estado de oxidación más bajo.

Tiene propiedades fuertemente oxidantes, por lo que se usa en aplicaciones en donde se requiere esta característica, como por ejemplo en la preparación de diversos compuestos orgánicos y como reactivo de laboratorio.
En el pasado fue muy utilizado para preparar colorantes basados en plomo, donde también actuaba como fijador de los colores en los tejidos. Esta aplicación fue abandonada debido a la toxicidad del plomo.
Ha sido empleado en la industria metalúrgica de diversas maneras, y recientemente se ha encontrado su utilidad para formar, junto a otros compuestos, materiales con altas capacidades de absorción de luz y de transformación de esta en electricidad.
Sin embargo, es una sustancia peligrosa porque puede favorecer la generación de incendios. Además es tóxico para el ser humano, animales y plantas, por lo que no debe desecharse nunca en el ambiente.
Índice del artículo
Es un compuesto iónico formado por un catión Pb2+ y dos aniones NO3–. En el anión nitrato los oxígenos se disponen de forma simétrica alrededor del nitrógeno y se alternan el doble enlace con este.
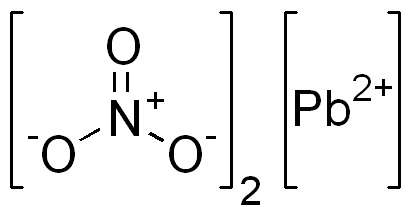
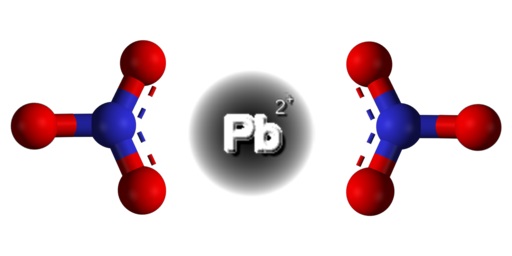
El plomo en este compuesto tiene la siguiente configuración electrónica:
[Xe] 4f14 5d10 6s2 6p0, donde se observa que ha perdido los 2 electrones de la última capa.
- Nitrato de plomo
- Nitrato de plomo (II)
- Nitrato plumboso
- Dinitrato de plomo
Sólido cristalino blanco o incoloro. Cristales cúbicos.
331 g/mol
470 ºC. Según algunas fuentes se descompone a esta temperatura.
4,53 g/cm3
Muy soluble en agua: 59,7 g/100 mL de agua a 25 °C. Ligeramente soluble en etanol. Insoluble en ácido nítrico (HNO3) concentrado.
Una solución acuosa con 20% de Pb(NO3)2 posee un pH de 3,0-4,0.
Es un agente oxidante. Reacciona violentamente con materiales combustibles y reductores.
No es combustible pero puede acelerar el quemado de materiales que sí lo son. Si se calienta hasta su descomposición emite gases tóxicos de óxido de nitrógeno:
2 Pb(NO3)2 + calor → 2 PbO + 4 NO2↑ + O2↑
Al disolverse en agua se ioniza:
Pb(NO3)2 + H2O → Pb2+ + 2 NO3–
Se puede preparar haciendo reaccionar plomo metálico, monóxido de plomo (PbO) o carbonato de plomo PbCO3 con ácido nítrico. Es conveniente emplear exceso del ácido para evitar que se formen nitratos básicos.
PbO + 2 HNO3 (concentrado) → Pb(NO3)2↓ + H2O
Su capacidad oxidante tiene aplicación en la preparación de diversos compuestos.
Ha sido empleado para sintetizar calixarenos, que son compuestos orgánicos cuya molécula tiene la forma de una cesta que permite albergar otras sustancias dependiendo del uso que se le dará.
Sirve para obtener isotiocianatos (R-NCS) partiendo de aminas (R-NH2).
Se usa a escala industrial para preparar benzaldehído oxidando cloruro de bencilo. También sirve como catalizador para la esterificación de compuestos orgánicos, por ejemplo en la obtención de poliésteres.
Se utiliza como reactivo en la determinación de aluminio y plomo en minerales y rocas.
Algunos colorantes de cromo requieren el uso de Pb(NO3)2 para su obtención. Por ejemplo, para teñir de amarillo el algodón, este se recubre con nitrato de plomo y se trata con sulfato de sodio para producir sulfato de plomo.
Luego se aplica una solución diluida de dicromato de sodio para formar cromato de plomo (PbCrO4) que es un pigmento amarillo.

Sin embargo, hoy en día se han dejado de utilizar los pigmentos de plomo por su toxicidad.
También actúa como mordiente para fijar los tintes durante de la coloración o impresión de otros tipos de fibra.
Se utilizaba antiguamente como agente cáustico en el tratamiento de chancros o gangrenas en caballos.
El nitrato de plomo se usa en la refinación electrolítica del plomo, como agente para favorecer la flotación en la remoción de titanio de ciertas arcillas, permite recuperar metales preciosos de soluciones de cianuro y se emplea en la electrodeposición de PbO2 en ánodos de níquel.
Se ha utilizado en forma de solución acuosa para fabricar celdas solares basadas en perovskita, un mineral de óxido de titanio.
El material sintetizado es una perovskita organometálica o perovskita de yoduro de plomo que ha llamado la atención de los investigadores, pues posee una alta capacidad de absorción de luz y una gran longitud de difusión de los portadores de carga.
Estas características lo convierten en un excelente candidato para dispositivos fotovoltaicos, esto es, que convierten luz en corriente eléctrica.
El (PbNO3)2 se ha empleado también:
- en la manufactura de fósforos, ciertos explosivos y materiales pirotécnicos,
- en fotografía como agente sensibilizante para recubrir el papel en fototermografía,
- en la industria textil para mejorar el rayón y estabilizar el nylon,
- en la eliminación de roedores.

Aunque no es un compuesto combustible, si se encuentra expuesto a fuego o calor puede explotar, generando óxidos de nitrógeno tóxicos.
Por ser un agente fuertemente oxidante existe el peligro de que se genere un incendio si entra en contacto con materiales orgánicos.
Produce irritación en los ojos, tracto respiratorio y digestivo. Es tóxico por inhalación e ingestión. Los síntomas más comunes de intoxicación por este compuesto son desórdenes gastrointestinales, cólicos, constipación y debilidad que puede convertirse en parálisis de algunos músculos, entre otros.
Su ingestión también puede causar dolor, calambres, depresión, coma y muerte.
Es tóxico para los organismos acuáticos y terrestres, además sus daños son persistentes y se bioacumula en los seres vivos, por lo tanto se considera un contaminante peligroso y no debe desecharse al ambiente.
Si por accidente es derramado en agua debe neutralizarse con óxido de calcio (CaO), carbonato de calcio (CaCO3) o bicarbonato de sodio (NaHCO3).
Se ha confirmado que es carcinógeno para los animales y posiblemente para el ser humano.
- U.S. National Library of Medicine. (2019). Lead(II) nitrate. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Hsieh, T.Y. et al. (2015). Efficient Perovskite Solar Cell Fabricated Using an Aqueous Lead Nitrate Precursor. Chem Commun (Camb). 2015 Sep 4; 51(68): 13294-7. Recuperado de ncbi.nlm.nih.gov.
- Vratny, F. and Gugliotta, F. (1963). The Thermal Decomposition of Lead Nitrate. J. Inorg. Nucl. Chem., 1963, Vol. 25, pp. 1129-1132. Recuperado de sciencedirect.com.
- Chakraborty, J.N. (2014). Dyeing with mineral colours. In Fundamentals and Practices in Colouration of Textiles. Recuperado de sciencedirect.com.
- Kumari, H. and Atwood, J. (2017). Calixarenes in the Solid State. In Reference Module in Chemistry, Molecular Sciences and Chemical Engineering. Recuperado de sciencedirect.com.
- Jeffery, P.G. and Hutchison, D. (1981). Aluminum. In Chemical Methods of Rock Analysis (Third Edition). Recuperado de sciencedirect.com
- Sandler, S.R. and Karo, W. (1992). Cyanates, Isocyanates, Thiocyanates, and Isothiocyanates. In Sourcebook of Advanced Organic Laboratory Preparations. Recuperado de sciencedirect.com.
- Smith, P.W.G. et al. (1969). Aromatic Halogen Compounds. In Aromatic Chemistry. Recuperado de sciencedirect.com.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- Lide, D.R. (editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Wikimedia Foundation (2020). Lead(II) nitrate. Recuperado de en.wikipedia.org.
- Shinde, D.V. et al. (2017). Enhanced Efficiency and Stability of an Aqueous Lead-Nitrate-Based Organometallic Perovskite Solar Cell. ACS Appl. Mater. Interfaces 2017, 9, 14023-14030. Recuperado de pubs.acs.org.
