Metionina: características, funciones, alimentos, beneficios
La metionina (Met, M) es un aminoácido clasificado dentro del grupo de los aminoácidos hidrofóbicos o apolares. Este aminoácido contiene azufre (S) en su cadena lateral que puede reaccionar con átomos metálicos o con grupos electrófilos.
La metionina fue descubierta por John Howard Mueller en la segunda década del siglo XX. Mueller aisló la metionina a partir de caseína, una proteína que él utilizaba para el crecimiento de los cultivos de estreptococos hemolíticos.
El nombre de “metionina” es una abreviatura del nombre químico de este aminoácido: el ácido γ-metiltiol-α-aminobutírico, y fue introducido por S. Odake en 1925.
Es un aminoácido esencial para los mamíferos y puede entrar en la ruta de la síntesis de cisteína, aminoácido no esencial, mientras el cuerpo obtenga metionina a partir de la dieta. Las plantas y las bacterias lo sintetizan a partir de la homocisteína, un derivado de la cisteína y de la homoserina.
Su catabolismo implica, por un lado, la eliminación del nitrógeno de su estructura y su excreción como urea y, por otro, la transformación de su cadena carbonada en succinil CoA.
Junto con la valina y la treonina, la metionina se considera un aminoácido glucogénico, puesto que estos aminoácidos pueden convertirse en succinato y entrar al ciclo de Krebs. Los aminoácidos glucogénicos son capaces de originar carbohidratos y, por ende, glucosa.
Existen muchos alimentos ricos en metionina como el atún, las carnes, la clara de huevo, los quesos y los frutos secos.
La metionina es fundamental para la síntesis de muchas proteínas, cumple con funciones importantes en el metabolismo de las grasas, principalmente para el músculo esquelético, y también participa como antioxidante.
Existen numerosos trastornos relacionados con el metabolismo de la metionina y del azufre que se asocian a patologías con distinto grado de implicaciones para la salud. Algunos inducen a la acumulación de homocisteína, lo que se acompaña de trombosis, alteraciones del sistema nervioso central (SNC), grave retraso mental y del sistema esquelético.
Otras, como la falta de la adenosiltransferasa, que es la primera enzima que actúa en la degradación de la metionina, trae como consecuencia la acumulación de metionina, una patología relativamente benigna que se controla restringiendo los alimentos ricos en metionina de la dieta.
Índice del artículo
- 1 Características
- 2 Estructura
- 3 Funciones
- 4 Biosíntesis
- 5 Degradación
- 6 Alimentos ricos en metionina
- 7 Beneficios de su ingesta
- 8 Trastornos por deficiencia
- 9 Referencias
La metionina es un aminoácido esencial que no es producido por el cuerpo humano ni por el de muchos. Este es un excelente antioxidante y una fuente de azufre para nuestro cuerpo.
Los requerimientos diarios de metionina para los lactantes son de 45 mg/día, en niños es de 800 mg/día y en adultos se encuentra entre 350 y 1.100 mg/día.
La metionina es una de las principales fuentes de azufre del organismo; el azufre es un componente fundamental de algunas vitaminas como la tiamina o vitamina B1, de algunas hormonas como el glucagón, la insulina y algunas hormonas hipofisarias.
Está en la queratina, que es una proteína de la piel, uñas y pelo, y también es importante para la síntesis de colágeno y creatina. Por lo tanto, la metionina al ser la fuente de azufre se relaciona con todas las funciones del azufre o de las sustancias orgánicas que lo contienen.
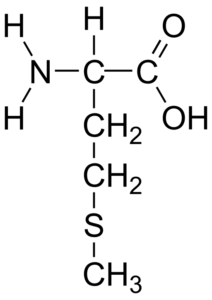
La fórmula química de la metionina es HO2CCH(NH2)CH2CH2SCH3 y su fórmula molecular es C5H11NO2S. Es un aminoácido esencial hidrofóbico, clasificado dentro de los aminoácidos apolares.
Tiene un carbono α unido a un grupo amino (—NH2), a un grupo carboxilo (—COOH), a un átomo de hidrógeno y a una cadena lateral (—R) que contiene azufre y que está constituida de la siguiente forma: —CH2—CH2—S—CH3.
Todos los aminoácidos, con excepción de la glicina, pueden existir como enantiómeros en forma L o D, por lo que puede existir L-metionina y D-metionina. Sin embargo, solo la L-metionina se encuentra en la estructura de las proteínas celulares.
Este aminoácido tiene unas constantes de disociación pK 1 de 2.28 y pK2 de 9.21, y un punto isoeléctrico de 5.8.
La metionina es un aminoácido esencial para la síntesis de muchas proteínas, entre las que están algunas hormonas, las proteínas constitutivas de la piel, pelo y uñas, etc.
Se usa como relajante natural para dormir y es muy importante para el buen estado de las uñas, la piel y el cabello. Previene algunas enfermedades hepáticas y cardíacas; evita la acumulación de grasas en las arterias y es indispensable para la síntesis de cisteína y taurina.
Favorece el uso de grasas como energía e interviene en el transporte y la utilización de las mismas, sobre todo en el músculo esquelético, por lo que es muy importante para el ejercicio muscular.
Reduce los niveles de histamina. Es un antioxidante natural, pues ayuda a reducir los radicales libres. También tiene propiedades antidepresivas y ansiolíticas.
Otro uso reciente de la metionina como “radiotrazador” para el estudio imagenológico en las tomografías por emisión de positrones (PET) en el campo de la neuro-oncología.
También tiene un extensivo uso como radio-contraste para los gliomas, tanto en el proceso de planificación de las extracciones quirúrgicas, como para el monitoreo de la respuesta al tratamiento y la evaluación de las recurrencias.
Recientemente se ha probado eficientemente el uso de la metionina para mejorar el crecimiento de las plantas de soya.
La biosíntesis de metionina fue descrita y publicada en 1931 por el británico George Barger y su asistente Frederick Philip Coine.
Las bacterias y las plantas pueden sintetizar metionina y cisteína, sin embargo, la mayor parte de los animales obtienen la metionina de la dieta y la cisteína a partir de una ruta biosintética que parte de metionina como sustrato inicial (también adquieren cisteína con los alimentos consumidos en la dieta).
Las plantas y las bacterias utilizan la cisteína como fuente de azufre y la homoserina como fuente del esqueleto carbonado para la síntesis de metionina. La homoserina la sintetizan a partir de aspartato por medio de tres reacciones enzimáticas:
(1) El aspartato se convierte en β-aspartil fosfato por medio de una enzima aspartato quinasa, luego (2) se convierte en β-semialdehído aspártico, que (3) gracias a la acción de la homoserina deshidrogenasa genera homoserina.
El primer paso de la síntesis de metionina es la reacción de la homoserina con el succinil-CoA para formar O-succinil homoserina. En esta reacción, el succinil-CoA es escindido, con lo que se libera la porción CoA y el succinato se une a la homoserina.
En la ruta biosintética, el paso regulado o de control es esta primera reacción enzimática, ya que la metionina, que es el producto final, termina inhibiendo la enzima homoserina succinil transferasa.
El segundo paso de la síntesis es la reacción de la O-succinil homoserina con la cisteína, que es catalizada por la enzima cistationina γ-sintetasa, con la generación de cistationina.
La tercera reacción de esta ruta es catalizada por la β-cistationina, que rompe la cistatiotina de manera que el azufre queda unido a una cadena lateral de cuatro átomos de carbono que deriva de la homoserina. El resultado de esta reacción es la formación de homocisteína y la liberación de 1 piruvato y 1 ion NH4+.
La última reacción es catalizada por la homocisteína metiltransferasa, que tiene como sustrato a la homocisteína y junto a la coenzima metilcobalamina (derivada de la vitamina B12 (cianocobalamina)) transfiere un grupo metilo desde el 5-metiltetrahidrofolato al grupo sulfhidrilo de la homocisteína y da origen a la metionina.
En esta reacción queda libre un tetrahidrofolato.
La metionina, la isoleucina y la valina se catabolizan a succinil-CoA. Las tres quintas partes de los carbonos de la metionina forman succinil-CoA, los carbonos de los carboxilos forman CO2 y el grupo metilo de la metionina se elimina como tal.
El primer paso de la degradación de la metionina implica la condensación de la L-metionina con ATP por medio de la L-metionina adenosil transferasa dando origen a la S-adenosil-L-metionina, llamada también “metionina activa”.
El grupo S-metilo es transferido a varios aceptores y así se forma la S-adenosil-L-homocisteína que pierde por hidrólisis una adenosina y se convierte en L-homocisteína. Luego la homocisteína se une a la serina para formar cistationina. Esta reacción es catalizada por la cistationina β-sintetasa.
La cistationina se hidroliza y da origen a L-homoserina y a cisteína. Es así como la homocisteína origina a la homoserina y la serina genera cisteína, por lo que esta reacción es común para la biosíntesis de cisteína a partir de serina.
A continuación, la homoserina desaminasa convierte la homoserina en α-cetobutirato, liberándose un NH4. El α-cetobutirato, en presencia de CoA-SH y NAD+, forma propionil-CoA, que luego se convierte en metilmalonil-CoA y este se convierte en succinil-CoA.
De esta forma, parte de la cadena carbonada de la metionina termina formando un sustrato gluconeogénico, el succinil-CoA, que entonces podrá integrarse a la síntesis de glucosa; es por esta razón que la metionina se considera un aminoácido glucogénico.
Una ruta alternativa para la degradación de la metionina es su empleo como sustrato energético.
El nitrógeno de la metionina, como el de todos los aminoácidos, es removido del carbono α por transaminación, y este grupo α-amino es finalmente transferido al L-glutamato. Por desaminación oxidativa, ese nitrógeno entra al ciclo de la urea y es eliminado por la orina.
Entre los alimentos ricos en metionina se encuentran:
– La clara de huevo.
– Derivados lácteos como el queso madurado, el queso crema y el yogurt.
– El pescado, especialmente los llamados pescados azules como el atún o el pez espada.
– El cangrejo, la langosta y el camarón son fuentes importantes de metionina.
– Las carnes de cerdo, de vaca y de pollo.
– Las nueces y otros frutos secos son ricos en metionina y representan sustitutos proteicos para los vegetarianos y veganos.
– Las semillas de sésamo, de calabaza y el pistacho.
También se encuentra en los frijoles blancos y negros, en la soya, en el maíz y en vegetales de hojas verdes como las hojas de nabo, la espinaca y las acelgas. El brócoli, calabacín y la calabaza son ricos en metionina.
Siendo un aminoácido esencial, su ingesta es indispensable para cumplir con todas las funciones en la que participa. Al fomentar el transporte de las grasas para su empleo combustible energético, la metionina protege al hígado y a las arterias contra la acumulación de grasas.
Su ingesta es beneficiosa para la protección del organismo contra afecciones como el hígado graso y la aterosclerosis.
La metionina ha demostrado ser eficiente para el tratamiento de algunos casos severos de mieloneuropatias inducidas por óxido nítrico y anemias macrocíticas que no responden al tratamiento con vitamina B12.
El uso de la S-adenosil-L-metionina (SAM) es efectivo como tratamiento natural y alternativo para de la depresión. Ello se debe a que el SAM es una donador de grupos metilos que está involucrado en la síntesis de varios neurotransmisores con propiedades antidepresivas en el cerebro.
El estrés oxidativo está involucrado, al menos en parte, en el daño de varios órganos, entre ellos el hígado, los riñones y el cerebro. El uso de antioxidantes como la metionina ha sido postulado para prevenir y corregir los daños causados por el estrés oxidativo.
Existen algunas patologías relacionadas con el metabolismo de la metionina, que tienen que ver con su absorción intestinal, lo que trae como consecuencia la acumulación de ciertos metabolitos o el déficit franco del aminoácido.
En el caso de los trastornos metabólicos de la metionina los más comunes son las llamadas homocistinurias que son de tipo I, II, III y IV:
Las homocistinurias de tipo I se deben al déficit de cistationina β-sintetasa y se acompañan de síntomas clínicos semejantes a la trombosis, osteoporosis, luxación del cristalino y, frecuentemente, retraso mental.
Las homocistinurias de tipo II se producen por el déficit de N5N10-metilentetrahidrofolato reductasa. Las homocistinurias de tipo III se deben a la disminución de la N5-metiltetrahidrofolato-homocisteína transmetilasa, por déficit de síntesis de metilcobalamina.
Y por último, las homocistinurias de tipo IV se relacionan con una reducción de la N5-metiltetrahidrofolato-homocisteína transmetilasa debido a la absorción defectuosa de cobalamina.
Las homocistinurias son defectos hereditarios del metabolismo de la metionina y se presentan con una frecuencia en 1 de cada 160.000 recién nacidos. En esta patología se excretan diariamente unos 300 mg de homocistina junto con S-adenosil metionina, lo que se acompaña de un incremento en la metionina plasmática.
La reducción de la ingesta de metionina y el aumento de cisteína en la dieta en etapas tempranas de la vida evita los cambios patológicos inducidos por dichas enfermedades y permite un desarrollo normal.
En el caso del déficit por malabsorción de metionina, los efectos más importantes se relacionan con fallas en la mielinización de las fibras nerviosas del sistema nervioso central (SNC) que pueden asociarse a cierto grado de retraso mental.
- Bakhoum, G. S., Badr, E. A. Elm., Sadak, M. S., Kabesh, M. O., & Amin, G. A. (2018). Improving Growth, Some Biochemical Aspects and Yield of Three Cultivars of Soybean Plant by Methionine Treatment Under Sandy Soil Condition. International Journal of Environmental Research, 13, 1–9.
- Mathews, C., van Holde, K., & Ahern, K. (2000). Biochemistry (3th ed.). San Francisco, California: Pearson.
- Mischoulon, D., & Fava, M. (2002). Role of S-adenosyl-L-methionine in the treatment of depression: A review of the evidence. American Journal of Clinical Nutrition, 76(5), 1158S-1161S.
- Murray, R., Bender, D., Botham, K., Kennelly, P., Rodwell, V., & Weil, P. (2009). Harper’s Illustrated Biochemistry (28th ed.). McGraw-Hill Medical.
- Patra, R. C., Swarup, D., & Dwivedi, S. K. (2001). Antioxidant effects of α tocopherol, ascorbic acid and L-methionine on lead induced oxidative stress to the liver, kidney and brain in rats. Toxicology, 162(2), 81–88.
- Rawn, J. D. (1998). Biochemistry. Burlington, Massachusetts: Neil Patterson Publishers.
- Stacy, C. B., Di Rocco, A., & Gould, R. J. (1992). Methionine in the treatment of nitrous-oxide-induced neuropathy and myeloneuropathy. Journal of Neurology, 239(7), 401–403.
