Diclorometano: estructura, propiedades, usos, toxicidad
El diclorometano, también conocido como cloruro de metileno, es un compuesto orgánico cuya fórmula química es CH2Cl2. Específicamente, se trata de un halogenuro de alquilo derivado del gas metano. A diferencia del metano, este compuesto es un líquido incoloro y polar.
Fue inicialmente sintetizado en 1839 por el químico y físico francés Henri Victor Regnault (1810-1878), quien logró aislarlo de una mezcla de cloro y clorometano expuesta a la luz solar.
El diclorometano se produce industrialmente por el tratamiento de metano o clorometano con gas cloro a temperatura elevada (400–500 ºC). Conjuntamente con el diclorometano, se producen en el proceso cloroformo y tetracloruro de carbono, los cuales son separados mediante destilación.
El diclorometano se usa como solvente que permite la soldadura de materiales plásticos y para desengrasar metales. También se utiliza en al descafeinado de café y té, así como extractor de lúpulo y diluyente para aditivos de color y tintas para marcar frutas.
El diclorometano es un compuesto tóxico que puede producir por inhalación irritación de las fosas nasales y la garganta. Se ha reportado daños hepáticos en trabajadores expuestos a concentraciones elevadas del diclorometano. Además, es agente mutagénico, siendo sospecho de ser carcinogénico.
Índice del artículo
- 1 Estructura
- 2 Propiedades
- 2.1 Apariencia
- 2.2 Masa molar
- 2.3 Olor
- 2.4 Umbral de olor
- 2.5 Densidad
- 2.6 Punto de fusión
- 2.7 Punto de ebullición
- 2.8 Solubilidad en agua
- 2.9 Solubilidad en otros solventes
- 2.10 Coeficiente de partición octanol/agua
- 2.11 Presión de vapor
- 2.12 Densidad del vapor
- 2.13 Índice de refracción (πD)
- 2.14 Viscosidad
- 2.15 Punto de ignición
- 2.16 Temperatura de autoignición
- 2.17 Estabilidad
- 2.18 Descomposición
- 2.19 Corrosión
- 2.20 Calor de vaporización
- 2.21 Tensión superficial
- 2.22 Reactividad
- 3 Usos
- 4 Toxicidad
- 5 Referencias
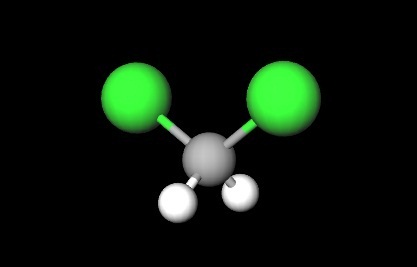
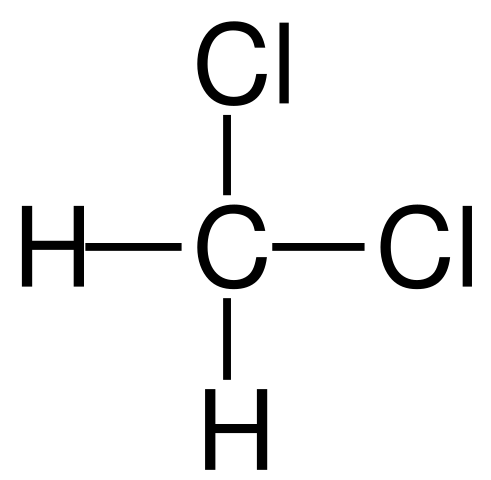
En la primera imagen se mostró la fórmula estructural del CH2Cl2, en la que resaltan sus enlaces covalentes C-H y C-Cl. Arriba se cuenta además con su estructura representada por un modelo de esferas y barras. Nótese a simple vista que los enlaces C-H (esferas blancas) son cortos, mientras que los enlaces C-Cl (esferas verdes) son largos.
La geometría del CH2Cl2 es tetraédrica; pero distorsionada a causa de los átomos más voluminosos de cloro. Un extremo del tetraedro lo definen los dos átomos de cloro, más electronegativos que los de hidrógeno y carbono. Por lo tanto, en la molécula de CH2Cl2 se establece un momento dipolar permanente (1.6D).
Esto le permite a las moléculas del diclorometano interactuar unas con otras mediante fuerzas dipolo-dipolo. Asimismo, son estas interacciones intermoleculares las responsables de que este compuesto exista como un líquido a pesar de su baja masa molecular; un líquido que, sin embargo, es bastante volátil.
Líquido incoloro.
84,93 g/mol.
Dulce, semejante al del cloroformo.
205 – 307 ppm.
1,3266 g/cm3 (20 ºC).
– 97,6 ºC.
39,6 ºC.
25,6 g/L a 15 ºC y 5,2 g/L a 60 ºC.
El diclorometano es apenas soluble en agua. Si bien ambas moléculas, CH2Cl2 y H2O, son polares, sus interacciones resultan ineficientes posiblemente por la repulsión entre los átomos de cloro y oxígeno.
Miscible con acetato de etilo, alcohol, hexano, benceno, tetracloruro de carbono, éter dietílico, cloroformo y dimetilformamida.
Log P = 1,19.
57,3 kPa (25 ºC). Esta presión corresponde aproximadamente a unas 5,66 atm, reflejando una alta presión de vapor.
2,93 en relación al aire tomado como 1.
1,4244 (20 ºC).
0,413 cP (25 ºC).
El diclorometano no es inflamable, pero al mezclarse con el aire forma vapores inflamables arriba de 100 ºC.
556 ºC.
Es estable a temperatura ambiental en ausencia de humedad, teniendo una estabilidad relativa cuando es comparado con sus congéneres: cloroformo y tetracloruro de carbono.
Tiende a carbonizarse a temperaturas elevadas (300-450 ºC), cuando sus vapores entran en contacto con el acero y los cloruros metálicos.
Puede descomponerse al contacto con superficies calientes o una llama, emitiendo vapores tóxicos e irritantes de fosgeno y cloruro de hidrógeno.
El diclorometano ataca algunas formas de plásticos, cauchos y recubrimientos.
28,82 kJ/mol a 25 ºC.
28,20 dinas/cm a 25 ºC.
El diclorometano reacciona fuertemente con metales activos, tales como potasio, sodio y litio. Reacciona con bases fuertes, por ejemplo, tert-butóxido de potasio. Es incompatible con sustancias cáusticas, oxidantes y metales químicamente activos.
Adicionalmente, reacciona con el oxígeno líquido en aleaciones de sodio y potasio y tetróxido de nitrógeno. En contacto con el agua puede corroer algunos aceros inoxidables, níquel, cobre, así como también el hierro.
La mayor parte de los usos y aplicaciones del diclorometano se basan en sus propiedades como solvente. Debido a esta característica, el diclorometano se emplea en las industrias de alimentos, de transporte, de producción de medicinas, etc.
El diclorometano se utiliza en el descafeinado de los granos de café y de las hojas de té. También se emplea para la extracción del lúpulo para la cerveza, bebidas y otros aromatizantes para alimentos, así como para el procesamiento de especias.
El diclorometano se emplea para la preparación de la cefalosporina y ampicilina, además de la fabricación de antibióticos, esteroides y vitaminas.
También se utiliza como disolvente en la producción de triacetato de celulosa (CTA), empleada en la creación de películas de seguridad.
Es un compuesto ideal para la producción de placas de circuito impreso, utilizándose para desengrasar la superficie de aluminio antes de agregar la capa fotorresistente a la placa.
El diclorometano es un solvente que se encuentra en barnices y en separadores de pinturas, empleados para eliminar barnices o recubrimiento de pinturas de varios tipos de superficies.
Sirve para desengrasar piezas y superficies metálicas presentes en equipos ferroviarios, así como en componentes de aviones.
Se emplea como propelente de spray (aerosoles) y como agente de expansión para la espuma de poliuretano. También se utiliza como fluido en algunos tipos de luces navideñas.
La inhalación de diclorometano puede causar la irritación de las vías aéreas superiores, tos, sibilancia o falta de aire.
Puede producir enrojecimiento de la piel, y si el compuesto permanece un largo tiempo sobre la misma, provocar quemaduras químicas. En contacto con los ojos, el diclorometano produce una irritación severa que puede extenderse a una quemadura.
Además, actúa como una neurotoxina generando alteraciones visuales, auditivas y psicomotoras; pero estos efectos son reversibles al cesar la inhalación del diclorometano.
El diclorometano puede afectar al sistema nervioso central y generar dolor de cabeza, confusión mental, náuseas, vómitos y pérdida de memoria.
En los animales produce efectos nocivos sobre el hígado, los riñones, sistema nervioso central y sistema cardiovascular.
En cuanto la carcinogénesis, no se ha reportado un incremento significativo en las muertes por cáncer en los trabajadores expuestos al diclorometano. Sin embargo, los estudios en animales han mostrado un incremento atribuible a diclorometano en la incidencia de cáncer del hígado y de los pulmones, así como de tumores benignos de las glándulas mamarias.
- Morrison, R. T. y Boyd, R, N. (1987). Química Orgánica. 5ta Edición. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- National Center for Biotechnology Information. (2020). Dichloromethane. PubChem Database., CID=6344. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2020). Dichloromethane. Recuperado de: en.wikipedia.org
- Brumer. (14 de julio de 2018). Dichloromethane. Recuperado de: brumer.com
- MSDS Online. (2019). Dichloromethane (Methylene Chloride) Hazards & Safety Information. Recuperado de: msdsonline.com
- EPA. (2000). Methylene Chloride (Dichloromethane). [PDF]. Recuperado de: epa.gov
