Enlace metálico: qué es, propiedades, cómo se forma, ejemplos
¿Qué es el enlace metálico?
El enlace metálico es aquel que mantiene fuertemente unidos los átomos de los elementos metálicos. Está presente en los metales y define todas sus propiedades físicas que los caracterizan como materiales duros, dúctiles, maleables y buenos conductores del calor y la electricidad.
De todos los enlaces químicos, el enlace metálico es el único donde los electrones no se encuentran localizados exclusivamente entre un par de átomos, sino que se deslocalizan entre millones de ellos en una especie de pegamento o “mar de electrones” que los mantienen fuertemente unidos o cohesionados.
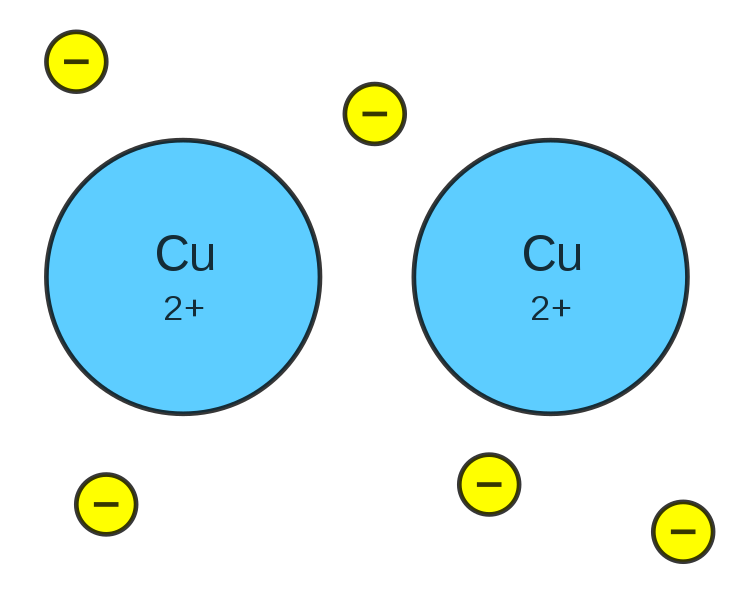
Por ejemplo, supóngase el metal cobre. En el cobre sus átomos Cu ceden sus electrones de valencia para formar el enlace metálico. Arriba este enlace se representa como cationes Cu2+ (círculos azules) rodeados de electrones (círculos amarillos). Los electrones no están quietos: se mueven por todo el cristal de cobre. No obstante, en los metales no se habla formalmente de cationes, sino de átomos metálicos neutros.
El enlace metálico se comprueba examinando las propiedades de los elementos metálicos, así como las de sus aleaciones. Estos integran una serie de materiales brillantes, plateados, tenaces, duros, que tienen además altos puntos de fusión y ebullición.
¿Cómo se forma el enlace metálico?
El enlace metálico se forma solamente entre un conjunto o grupo de átomos metálicos. Para que los electrones se deslocalicen por todo el cristal metálico, tiene que haber una “autopista” por la que puedan transitar. Esta se diseña a partir del traslape de todos los orbitales atómicos de los átomos vecinos.
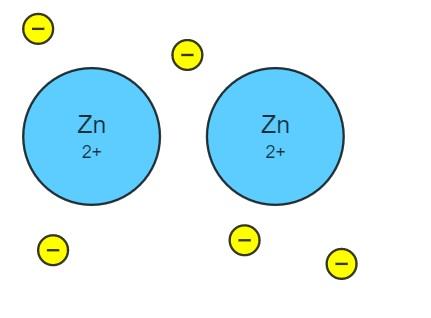
Por ejemplo, considérese una hilera de átomos de zinc, Zn···Zn···Zn···. Estos átomos traslapan sus orbitales atómicos de valencia para crear orbitales moleculares. A su vez, dichos orbitales moleculares se traslapan con otros orbitales de los átomos Zn vecinos.
Cada átomo de zinc aporta dos electrones para contribuir al enlace metálico. De esta manera, el traslape o unión de los orbitales moleculares, y los átomos donados por el zinc, originan una “autopista” por la que los electrones se deslocalizan por todo el cristal como si fueran un pegamento o un mar de electrones, cubriendo o bañando todos los átomos metálicos.
Propiedades del enlace metálico
Estructuras
El enlace metálico origina estructuras compactas, donde los átomos se encuentran estrechamente unidos, sin mucha distancia que los separe. Dependiendo del tipo de estructura en específico, se tienen distintos cristales, unos más densos que otros.
En las estructuras metálicas no se habla propiamente de moléculas, sino de átomos neutros (o cationes, según otras perspectivas). Retomando el ejemplo del cobre, en sus cristales compactados no hay moléculas Cu2, con un enlace covalente Cu-Cu.
Reorganización
El enlace metálico tiene la propiedad de reorganizarse. Esto no ocurre con los enlaces covalente e iónico. Si un enlace covalente se parte, no volverá a formarse como si no hubiera ocurrido nada. Asimismo, las cargas eléctricas en el enlace iónico son invariables a menos que tome lugar una reacción química.
Considérese por ejemplo el metal mercurio para explicar este punto.
El enlace metálico entre dos átomos adyacentes de mercurio, Hg···Hg, puede romperse y volverse a formar con otro átomo vecino si el cristal es sometido a una fuerza externa que lo deforme.
Así, el enlace se reorganiza mientras el cristal sufra la deformación. Esto le confiere a los metales las propiedades de ser materiales dúctiles y maleables. De lo contrario, se quebrarían como pedazos de vidrio o cerámica, aun en caliente.
Conductividades térmica y eléctrica
La propiedad que tiene el enlace metálico de tener sus electrones deslocalizados le confiere además a los metales la capacidad de conducir el calor y la electricidad. Esto se debe a que, al estar los electrones deslocalizados y moviéndose por todas partes, transmiten efectivamente las vibraciones atómicas como si de una onda se tratase. Estas vibraciones se traducen en calor.
Por otro lado, al moverse los electrones quedan espacios vacíos atrás que otros pueden ocupar, habiendo por lo tanto una vacancia electrónica por la cual pueden “correr” más electrones y originarse así una corriente eléctrica.
En principio, sin abordar las teorías físicas detrás del fenómeno, esta es la explicación general de la conductividad eléctrica de los metales.
Lustre metálico
Los electrones deslocalizados y móviles también pueden interaccionar con los fotones de la luz visible y rechazarlos. Dependiendo de las densidades y de la superficie del metal, puede exhibir distintas tonalidades grisáceas o plateadas, o inclusive destellos iridiscentes. Los casos más excepcionales son los del cobre, mercurio y oro, que absorben fotones de ciertas frecuencias.
Deslocalización de los electrones
Para entender el enlace metálico es necesario comprender qué se entiende por la deslocalización de los electrones. Es imposible determinar dónde están los electrones. Sin embargo, sí puede estimarse en qué región del espacio es probable encontrarlos. En un enlace covalente A-B, el par de electrones se distribuye en el espacio que separa los átomos A y B; se dice entonces que están localizados entre A y B.
En un enlace metálico AB, no obstante, no puede afirmarse que los electrones se comportan del mismo modo que en un enlace covalente A-B. No están localizados entre dos átomos específicos de A y B, sino que se difuminan o se dirigen a otras partes del sólido donde también hay átomos compactados, es decir, estrechamente unidos, de A y B.
Cuando esto es así, se dice que los electrones del enlace metálico están deslocalizados: recorren cualquier dirección adonde haya átomos de A y B, tal como se mostró en la primera imagen con los átomos de cobre y sus electrones.
Por lo tanto, en el enlace metálico se habla de una deslocalización de estos electrones, y esta característica es responsable de muchas de las propiedades que tienen los metales. Sobre ella se sustenta además la teoría del mar de los electrones.
Ejemplos de enlaces metálicos
Algunos enlaces metálicos de uso común en la vida diaria son los siguientes:
– Elementos metálicos
Zinc

En el zinc, un metal de transición, sus átomos están unidos por el enlace metálico.
Oro (Au)
El oro puro, igual que las aleaciones de este material con cobre y plata, actualmente son sumamente empleados en la joyería fina.
Cobre (Cu)
Este metal es utilizado ampliamente en aplicaciones eléctricas, gracias a sus excelentes propiedades de conducción de electricidad.
Plata (Ag)
Dadas sus propiedades, este metal es muy utilizado tanto en aplicaciones de joyería fina como en el ámbito industrial.
Níquel (Ni)
En estado puro suele emplearse para la fabricación de monedas, baterías, fundición o piezas metálicas diversas.
Cadmio (Cd)
Es un material muy tóxico y se utiliza en la elaboración de baterías.
Platino (Pt)
Se utiliza en la joyería fina (aleaciones con oro), y en la elaboración de instrumentos de medición de laboratorio e implantes dentales.
Titanio (Ti)
Este metal es de uso común en la rama de la ingeniería, así como en la fabricación de implantes osteosintéticos, aplicaciones industriales y joyería.
Plomo (Pb)
Este material se utiliza en la elaboración de conductores eléctricos, más específicamente, para la fabricación de la cubierta externa de cables telefónicos y de telecomunicaciones.
– Compuestos metálicos
Acero común
La reacción del hierro con el carbono produce el acero común, un material mucho más resistente a esfuerzos mecánicos en comparación con el hierro.
Acero inoxidable
Es posible hallar una variación del material anterior mediante la combinación del acero común con metales de transición como el cromo y el níquel.
Bronce
Se produce al combinar cobre con estaño, en una proporción aproximada de 88% y 12%, respectivamente. Se usa en la elaboración de monedas, herramientas y ornamentos públicos.
Aleaciones de mercurio
Diversas aleaciones de mercurio con otros metales de transición, como la plata, el cobre y el zinc, producen las amalgamas empleadas en odontología.
Aleación de cromo y platino
Este tipo de aleación es muy utilizada para elaborar hojas de afeitar.
Pieltre
Esta aleación de estaño, antimonio, sobre y bismuto es de uso común para la elaboración de utensilios del hogar.
Latón
Se genera al combinar cobre con zinc, en una proporción de 67% y 33%, respectivamente. Se emplea en la fabricación de artículos de ferretería.
