Fermio: qué es, estructura, propiedades, usos, riesgos
¿Qué es el fermio?
El fermio (Fm) es un elemento químico radiactivo que se obtiene de manera inducida por transmutación nuclear, en la cual las reacciones de tipo nuclear son capaces de alterar de forma artificial el núcleo de un elemento considerado como estable, y así originar un isótopo de naturaleza radiactiva o un elemento que no exista de manera natural.
Este elemento fue descubierto en el año 1952, durante el primer ensayo nuclear exitoso “Ivi Mike”, llevado a cabo por un grupo de científicos de la Universidad de California bajo la dirección de Albert Ghiorso. El fermio se descubrió como producto de la primera explosión de una bomba de hidrógeno en el océano Pacífico.
Años más tarde el fermio se logró obtener sintéticamente en un reactor nuclear, bombardeando plutonio con neutrones; y en un ciclotrón, bombardeando uranio-238 con iones de nitrógeno.
Actualmente el fermio se produce a través de una larga cadena de reacciones nucleares, que implica bombardear cada isótopo de la cadena con neutrones y luego permitir que el isótopo resultante experimente una descomposición beta.
Estructura química del fermio
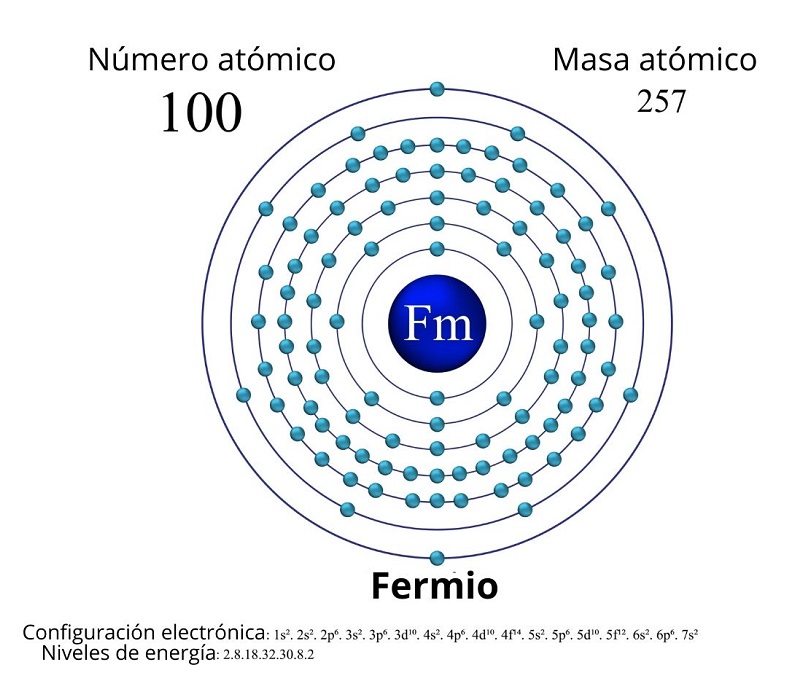
El número atómico del fermio (Fm) es 100 y su configuración electrónica es [Rn] 5f12 7s2. Además, se encuentra ubicado dentro del grupo de los actínidos que forman parte del período 7 de la tabla periódica y, dado que su número atómico es mayor a 92, es denominado elemento transuránico.
En este sentido, el fermio es un elemento sintético y, por lo tanto, no tiene isótopos estables. Por esta razón no posee una masa atómica estándar.
Asimismo, los átomos —que son isótopos entre sí— tienen igual número atómico, pero diferente masa atómica, considerando que existen entonces 19 isótopos conocidos del elemento, que van desde la masa atómica 242 hasta la 260.
Sin embargo, el isótopo que se puede producir en grandes cantidades en una base atómica es Fm-257, con una vida media de 100,5 días. Este isótopo es también el núclido de mayor número atómico y de masa jamás aislado de cualquier reactor o material producido por una instalación termonuclear.
Aunque el fermio-257 se produce en cantidades mayores, el fermio-255 ha estado más disponible de forma regular, y se utiliza con mayor frecuencia para estudios químicos en el nivel de trazador.
Propiedades del fermio
Las propiedades químicas del fermio se han estudiado solo con cantidades mínimas, de manera que toda la información química disponible que se ha obtenido es a partir de experimentos realizados con trazas del elemento. De hecho, en muchos casos estos estudios se realizan con solo unos pocos átomos, o incluso un átomo a la vez.
De acuerdo con la Royal Society of Chemistry, el fermio posee un punto de fusión de 1527 °C (2781 °F o 1800 K), su radio atómico es de 2,45 Å, su radio covalente es de 1,67 Å, y a una temperatura de 20 °C se encuentra en estado sólido (metal radiactivo).
Del mismo modo, la mayoría de sus propiedades tales como estado de oxidación, electronegatividad, densidad, punto de ebullición, entre otras, se desconocen.
Hasta la actualidad, nadie ha logrado producir una muestra suficientemente grande de fermio para poder verlo, aunque la expectativa es que, al igual que otros elementos similares, sea un metal gris plateado.
Comportamiento en soluciones
El fermio se comporta en condiciones no fuertemente reductoras en una solución acuosa como se espera para un ion actínido trivalente.
En ácido clorhídrico concentrado, ácido nítrico y soluciones de tiocianato de amonio, el fermio forma complejos aniónicos con estos ligandos (una molécula o ión que se une a un catión de metal para formar un complejo), que pueden adsorberse y luego eluirse a partir de columnas de intercambio aniónico.
En condiciones normales, el fermio existe en solución como el ion Fm3+, que tiene un índice de hidratación de 16,9 y una constante de disociación ácida de 1,6×10-4 (pKa = 3,8); de modo que se cree que la unión en los complejos de los actínidos posteriores es principalmente de carácter iónico.
Igualmente, se espera que el ion Fm3+ sea más pequeño que los iones An3+ (iones de plutonio, americio o curio) precedentes, debido a la mayor carga nuclear efectiva de fermio; por lo tanto, se esperaría que el fermio forme enlaces metal-ligando más cortos y fuertes.
Por otro lado, el fermio (III) puede reducirse bastante fácilmente a fermio (II); por ejemplo, con cloruro de samario (II), con el que coprecipita el fermio (II).
Potencial normal de electrodo
Se ha estimado que el potencial del electrodo es de aproximadamente -1,15 V con respecto al electrodo de hidrógeno estándar.
Asimismo, el par Fm2+/ Fm0 tiene un potencial de electrodo de -2,37 (10) V, basado en mediciones polarográficas; es decir, de voltamperometría.
Decaimiento radiactivo
Como todos los elementos artificiales, el fermio experimenta decaimiento radiactivo ocasionado principalmente por la inestabilidad que los caracteriza.
Esto es así debido a las combinaciones de protones y neutrones que no permiten mantener el equilibrio, y espontáneamente cambian o decaen hasta alcanzar una forma más estable, liberando ciertas partículas.
Este decaimiento radiactivo se da mediante una fisión espontánea a través de una descomposición alfa (por ser un elemento pesado) en californio-253.
Usos y riesgos
La formación de fermio no ocurre naturalmente y no se ha encontrado en la corteza terrestre, por lo que no hay razón para considerar sus efectos ambientales.
Debido a las pequeñas cantidades de fermio producido y su corta vida media, actualmente no hay usos para este fuera de la investigación científica básica.
En este sentido, tal como todos los elementos sintéticos, los isótopos de fermio son extremadamente radiactivos y se consideran altamente tóxicos.
Aunque pocas personas entran en contacto con el fermio, la Comisión Internacional de Protección Radiológica ha establecido límites anuales de exposición para los dos isótopos más estables.
Para el fermio-253, el límite de ingestión se estableció en 107 becquerel (1 Bq es equivalente a una descomposición por segundo) y el límite de inhalación en 105 Bq; para fermio-257, los valores son 105 Bq y 4000 Bq, respectivamente.
