Proteínas globulares: características, estructura, ejemplos
Las proteínas globulares son las proteínas que tienen una estructura terciaria en la que las cadenas peptídicas se arreglan en una conformación de aspecto globular. Gran parte de las proteínas celulares corresponde a este grupo, siendo de las más importantes las proteínas con actividad enzimática.
Las proteínas representan un tipo muy especial de moléculas en las células que forman a todos los seres vivos. Su estructura consiste en una combinación de 20 aminoácidos que se repiten en diferentes proporciones y que se unen entre sí a través de enlaces químicos, en un orden o secuencia determinado genéticamente.
Son sumamente abundantes y cumplen funciones esenciales desde muchos puntos de vista de la vida celular, hasta tal punto que sin ellas no sería posible la existencia de la vida como la conocemos.
Cada especie de ser vivo sobre la Tierra tiene un conjunto de proteínas específico y, más aún, los organismos pluricelulares tienen células que se diferencian unas de otras principalmente por las proteínas que producen.
Índice del artículo
- 1 Proteínas globulares y fibrosas
- 2 Características de las proteínas globulares
- 3 Estructura de las proteínas globulares
- 4 Ejemplos de proteínas globulares
- 5 Referencias
Los científicos dedicados al estudio de las proteínas las han clasificado tradicionalmente de acuerdo con muchos parámetros, pero uno de los más importantes es la estructura. Así, según la estructura tridimensional que estas adoptan, las proteínas pueden ser fibrosas o globulares.
Las proteínas fibrosas son aquellas que tienen un aspecto alargado, pues sus cadenas peptídicas generalmente son paralelas entre sí. Estas proteínas tienen muchas funciones, pero las más importantes tienen que ver con la estructura, el soporte y la biomecánica celular.
Dos ejemplos clásicos de proteínas fibrosas en el cuerpo humano y de otros animales son la queratina y el colágeno, que participan en la formación del pelo y las uñas (la primera) y de la piel, los huesos y los tendones (la última).
Las proteínas globulares, en cambio, son proteínas que tienen una conformación tridimensional más bien redondeada o esférica, por lo que pueden parecer un poco más compactas e irregulares. Estas proteínas no participan directamente de la estructura celular, pero sí tienen un papel funcional fundamental.

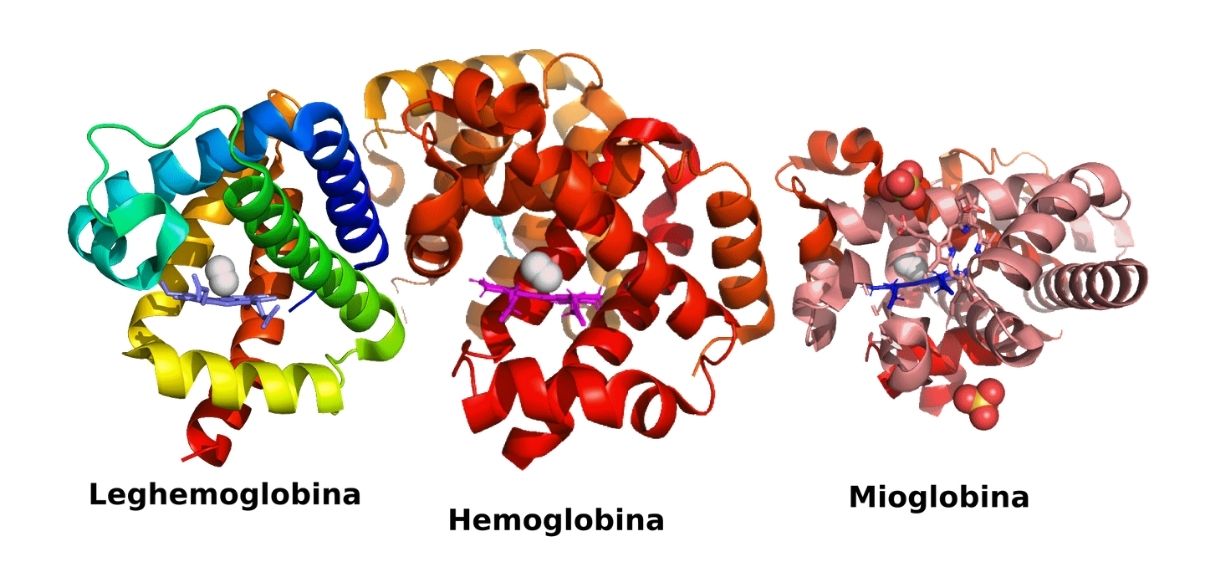
Ejemplos de proteínas globulares son las proteínas con actividad enzimática (enzimas) como la hemoglobina, que participa en el transporte de oxígeno por la sangre, y las inmunoglobulinas, que funcionan en el sistema inmune de los mamíferos.
Las proteínas globulares son parcialmente solubles en agua, aspecto de gran importancia, pues estas son verdaderamente abundantes en el medio acuoso del citosol y en el lumen de los distintos orgánulos celulares donde ejercen sus funciones.
Mientras que las proteínas fibrosas casi siempre están formadas por un tipo repetitivo de estructura secundaria, las proteínas globulares son más heterogéneas, ya que se caracterizan por presentar a lo largo de sus cadenas peptídicas distintos tipos de estructuras secundarias que se pliegan entre sí.
En el grupo de las proteínas globulares se encuentran todas las enzimas, gran cantidad de proteínas de transporte, proteínas reguladoras, proteínas motoras y muchas más, así que se trata de un grupo muy diverso, tanto desde el punto de vista de estructura y tamaño como de función.
Así como es cierto para las proteínas fibrosas, toda la información necesaria para conseguir el plegamiento y la conformación estructural de las proteínas globulares está determinada por la secuencia aminoacídica que, a su vez, depende de la información contenida en los genes que las codifican.
Generalmente estas proteínas se clasifican de acuerdo con su función, y cada categoría se divide también en muchas subcategorías. Un buen ejemplo de esto es la clasificación de las enzimas, que corrientemente se basa en el tipo de reacción en la que estas participan.
Las proteínas globulares se definen como tales gracias a la conformación nativa de sus estructuras terciarias, en las cuales las cadenas aminoacídicas se acomodan para formar una estructura relativamente esférica, generalmente tapizada con aminoácidos hidrofílicos (que interactúan con el agua) que protegen un núcleo más hidrofóbico (que no interactúa con el agua).
Al igual que las proteínas fibrosas, las proteínas globulares tienen una estructura primaria formada por la cadena lineal de los aminoácidos que las conforman, los cuales se acomodan en hélices alfa o láminas beta, dando lugar a la estructura secundaria.
La estructura terciaria de las proteínas globulares se forma espontáneamente y es mantenida por las interacciones entre las cadenas aminoacídicas que las conforman.
Se trata de una conformación compacta y semiesférica, tan compacta que se asemeja mucho a la de un cristal. La misma está determinada por las interacciones existentes entre las diferentes estructuras secundarias que puede haber en la misma cadena polipeptídica.
Se ha determinado que las fuerzas que mantienen la interacción entre dichas cadenas suelen ser de naturaleza débil, como las interacciones de van der Waals entre los aminoácidos más hidrofóbicos (enlaces apolares), o como los puentes de hidrógeno entre los aminoácidos más hidrofílicos (enlaces polares).
Además, muchas proteínas globulares, especialmente las de gran tamaño, tienen diferentes “lóbulos” o “dominios”, los cuales pueden tener funciones diferentes dentro de la misma molécula.
Así mismo, algunas proteínas globulares se encuentran en la naturaleza como grandes complejos proteicos, los cuales están compuestos por cadenas polipeptídicas discretas (separadas), también conocidas como subunidades, por lo que se dice que son proteínas con estructuras cuaternarias.
Existen muchísimos ejemplos de proteínas globulares, algunas imprescindibles para las funciones celulares y otras no tanto, pero, sea cual sea el caso, siempre su estructura está relacionada con su función.
A nivel celular podemos hablar, entonces, de algunas de las proteínas que participan en las vías metabólicas más importantes como serían:
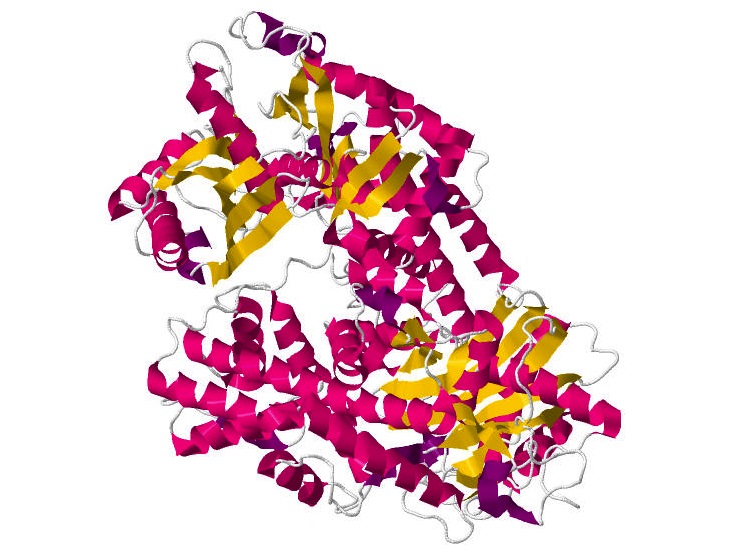
Es una proteína globular relativamente pequeña que se encuentra en casi todas las células vivas, donde se encarga de catalizar la reacción de fosforilación de residuos de glucosa en la primera parte de la ruta glucolítica.
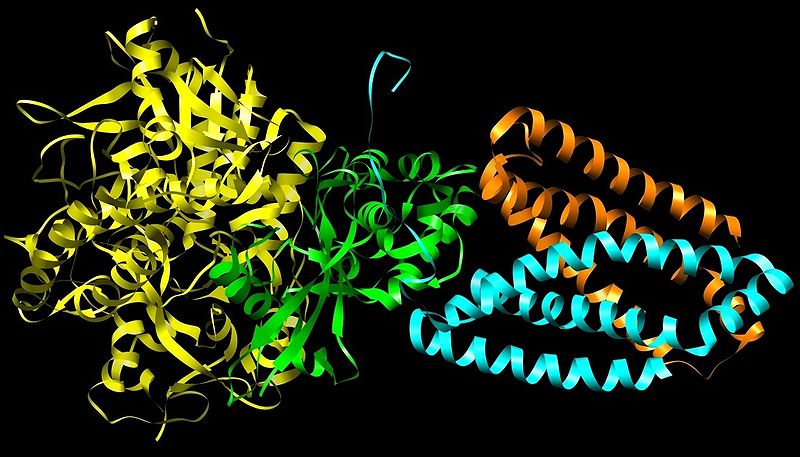
Es un complejo proteico mitocondrial que consiste en cuatro subunidades (A-D) y que participa tanto en el ciclo de ácidos tricarboxílicos (ciclo de Krebs) como en la cadena transportadora de electrones, dos procesos fundamentales para la producción de energía celular en forma de ATP.
En el cuerpo humano y en el de otros animales también hay otras proteínas muy importantes como la hemoglobina y las inmunoglobulinas.

Es, como la succinato deshidrogenasa, una proteína globular con estructura cuaternaria, pues está formada por dos pares de subunidades diferentes, conocidas como cadenas alfa y cadenas beta. Esta se encuentra en el interior de los glóbulos rojos de la sangre, donde participa en el transporte de oxígeno hacia los tejidos.
También es una proteína globular que se une al oxígeno, pero esta solo tiene una estructura terciaria y se encuentra exclusivamente en las células del músculo esquelético de los animales vertebrados.
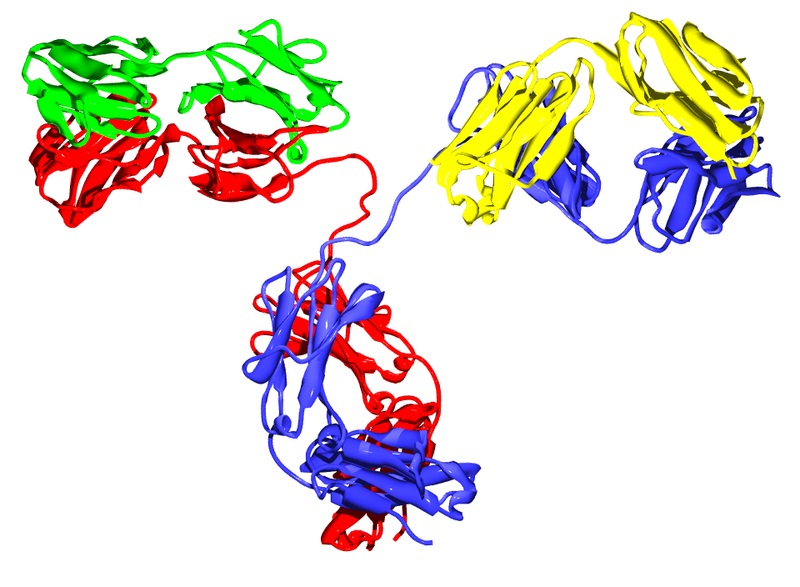
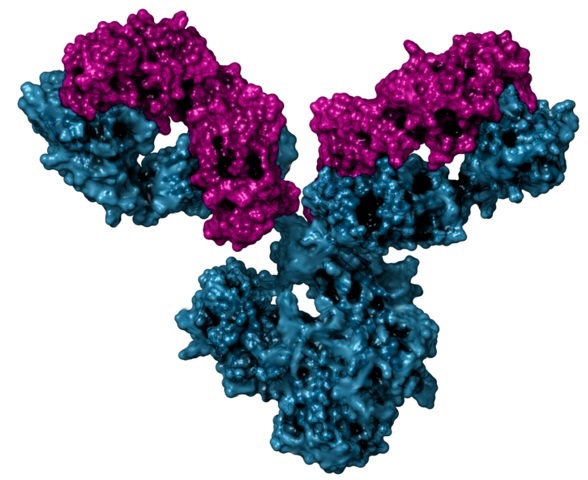
Son unas glicoproteínas globulares presentes en muchos animales, particularmente en la sangre, en la linfa y en algunos tejidos vascularizados, donde ejercen funciones como miembros del sistema inmune.
Así como la hemoglobina y la succinato deshidrogenasa, estas proteínas presentan estructura cuaternaria, pues están formadas por dos pares de subunidades: dos cadenas pesadas y dos cadenas ligeras.
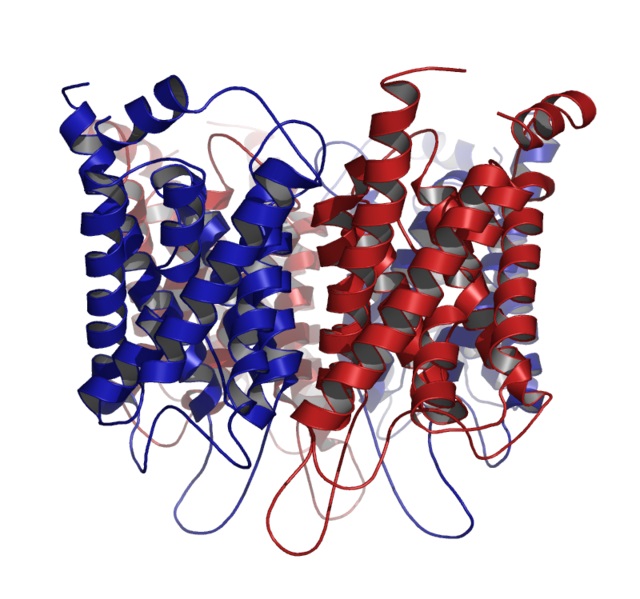
Otra proteína globular, común en células animales y vegetales, es la proteína que forma los canales membranales para el transporte de agua, mejor conocida como acuaporina.
Las acuaporinas se clasifican como proteínas globulares, pero son proteínas integrales de membrana que se arreglan en estructuras cuaternarias formadas por varias subunidades idénticas.
- Chan, H. S., & Dill, K. A. (1990). Origins of structure in globular proteins. Proceedings of the National Academy of Sciences, 87(16), 6388-6392.
- Grattendick, K., & Pross, S. (2007). Immunoglobulins.
- Gromiha, M. M. (2010). Protein bioinformatics: from sequence to function. academic press.
- Gromiha, M. M., Nagarajan, R., & Selvaraj, S. (2019). Protein Structural Bioinformatics: An Overview.
- Nelson, D. L., Lehninger, A. L., & Cox, M. M. (2008). Lehninger principles of biochemistry. Macmillan.
- Verkman A. S. (2013). Aquaporins. Current biology: CB, 23(2), R52–R55. https://doi.org/10.1016/j.cub.2012.11.025
