Ácido sulfuroso: qué es, estructura, propiedades, nomenclatura, usos
¿Qué es el ácido sulfuroso?
El ácido sulfuroso es un oxácido que se forma cuando el dióxido de azufre, SO2, se disuelve en agua. Es un ácido inorgánico débil e inestable, que no se ha podido detectar en solución, ya que la reacción de su formación es reversible y el ácido se descompone rápidamente en los reactivos que lo produjeron (SO2 y H₂O).
Es un líquido incoloro, con un fuerte olor a azufre, inestable, y se emplea en diversos ámbitos industriales, como blanqueador de materiales manchados por cloro, para la síntesis de productos medicinales y químicos, para la fabricación de papel, o para refinar derivados del petróleo.
La molécula del ácido sulfuroso por el momento solo ha sido detectada en la fase gaseosa. Las bases conjugadas de este ácido son aniones comunes bajo las formas de sulfitos y bisulfitos.
El espectro de Raman de soluciones SO2 solo muestra señales debidas a la molécula de SO2 y del ion bisulfito, HSO3–, consistente con el equilibrio siguiente:
SO2 + H₂O => HSO3– + H+
Esto señala que mediante el espectro de Raman no es posible detectar la presencia del ácido sulfuroso en una solución de dióxido de azufre en agua.
Cuando se expone a la atmósfera, se transforma rápidamente en ácido sulfúrico. El ácido sulfuroso se reduce a sulfuro de hidrógeno por la acción del ácido sulfúrico diluido y el cinc.
El intento de concentrar una solución de SO2 mediante la evaporación del agua para la obtención de ácido sulfuroso libre de agua, no produjo resultado, ya que el ácido se descompone rápidamente (invirtiendo la reacción de formación), por lo que el ácido no puede ser aislado.
Estructura del ácido sulfuroso
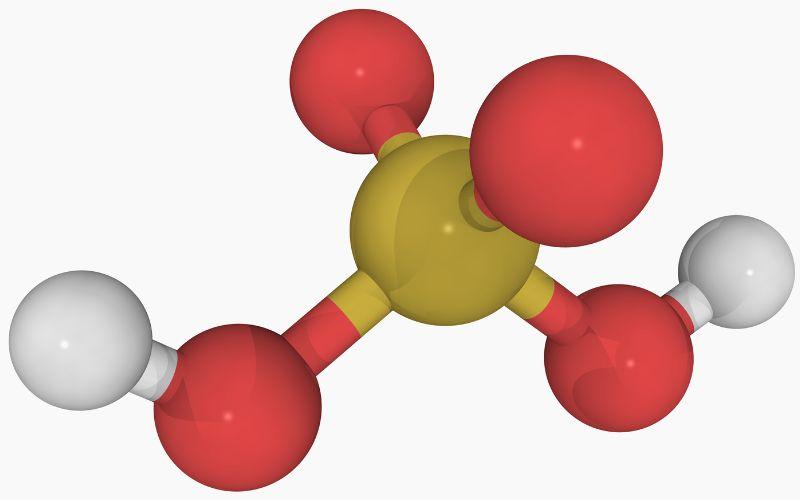
En la imagen principal puede apreciarse la estructura de una molécula aislada de ácido sulfuroso en estado gaseoso. La esfera amarilla en el centro corresponde al átomo de azufre, las rojas a los átomos de oxígeno, y las blancas a los hidrógenos.
Su geometría molecular en torno al átomo de S es pirámide trigonal, con los átomos de O dibujando la base.
Entonces, en el estado gaseoso, las moléculas de H2SO3 pueden considerarse como microscópicas pirámides trigonales flotando en el aire, suponiendo que sean lo suficientemente estables para perdurar cierto tiempo sin reaccionar.
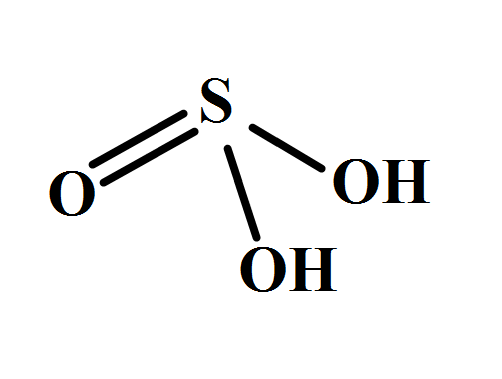
La estructura deja en claro de dónde provienen los dos hidrógenos ácidos: de los grupos hidroxilos enlazados al azufre, HO-SO-OH. Por lo tanto, para este compuesto, no es correcto asumir que uno de los protones ácidos, H+, se libera del átomo de azufre, H-SO2(OH).
Los dos grupos OH le permiten al ácido sulfuroso interaccionar mediante puentes de hidrógeno, y además, el oxígeno del enlace S=O es un aceptor de hidrógeno, lo que convierte al H2SO3 tanto en un buen donador como aceptor de dichos puentes.
Según lo anterior, el H2SO3 debería poder condensar en un líquido, tal como lo hace el ácido sulfúrico, H2SO4. Sin embargo, no ocurre así.
Propiedades físicas y químicas del ácido sulfuroso
Fórmula molecular
H2SO3
Peso molecular
82.073 g/mol.
Aspecto físico
Es un líquido incoloro, con un olor picante a azufre.
Densidad
1.03 g/ml.
Densidad del vapor
2.3 (en relación con el aire que se toma como 1)
Corrosividad
Es corrosivo para metales y tejidos.
Solubilidad en agua
Miscible con el agua.
Sensibilidad
Es sensible al aire.
Estabilidad
Estable, pero incompatible con bases fuertes.
Constante de acidez (Ka)
1.54 x 10-2
pKa
1.81
pH
1.5 en la escala de pH.
Punto de ignición
No inflamable.
Descomposición
Cuando se calienta, el ácido sulfuroso puede descomponerse, emitiendo un humo tóxico de óxido de azufre.
Nomenclatura
El azufre tiene las siguientes valencias: ±2, +4 y +6. A partir de la fórmula H2SO3, puede calcularse qué valencia o número de oxidación posee el azufre en el compuesto. Para ello, basta con resolver una suma algebraica:
2(+1) + 1v + 3(-2)= 0
Como se trata de un compuesto neutro, la suma de las cargas de los átomos que lo constituyen debe ser 0. Despejando v para la ecuación anterior, se tiene:
v= (6-2)/1
Así, v es igual a +4. Es decir, el azufre participa con su segunda valencia, y de acuerdo a la nomenclatura tradicional, debe añadirse al nombre el sufijo –oso. Por esta razón, al H2SO3 se le conoce como ácido sulfuroso.
Otra manera más rápida de determinar dicha valencia, es comparando el H2SO3 con el H2SO4.
En el H2SO4 el azufre tiene valencia +6, por lo que si se le quita un O, la valencia baja a +4, y si se le quita otro más, la valencia baja a +2 (que sería el caso para el ácido hiposulfuroso, H2SO2).
Aunque menos conocido, al H2SO3 también puede llamársele ácido trioxosulfúrico (IV), de acuerdo a la nomenclatura stock.
Formación del ácido sulfuroso en la naturaleza
El ácido sulfuroso se forma en la naturaleza por la combinación del dióxido de azufre, producto de la actividad de las grandes fábricas, con el agua atmosférica.
Por esta razón, se le considera como un producto intermedio de la lluvia ácida, provocando grandes daños a la agricultura y al medioambiente.
Síntesis
Técnicamente, se forma quemando azufre para formar dióxido de azufre. Después, este se disuelve en agua para formar el ácido sulfuroso. Sin embargo, la reacción es reversible y el ácido rápidamente se descompone de regreso en los reactantes.
Esta es una explicación del porqué no se encuentra el ácido sulfuroso en solución acuosa (como ya se mencionó en el apartado de su estructura química).
Usos
Generalmente, los usos y aplicaciones del ácido sulfuroso, dado que no se puede detectar su presencia, se refieren a los usos y aplicaciones de las soluciones de dióxidos de azufre y las bases y sales del ácido.
En la madera
En el proceso de sulfito se produce pulpa de madera en forma de fibras de celulosa casi puras. Se usan varias sales del ácido sulfuroso para la extracción de la lignina de las astillas de la madera, utilizando recipientes de gran presión llamados digestores.
Agente desinfectante
El ácido sulfuroso se utiliza como un desinfectante.
Blanqueador
También se utiliza como un agente blanqueador suave, especialmente para materiales sensibles al cloro. Además, se emplea como blanqueador dental y aditivo de alimentos.
Cosmética
Es ingrediente de diversos cosméticos para el cuidado de la piel y se usó como un elemento pesticida en la eliminación de las ratas. Elimina las manchas ocasionadas por el vino o frutas en diferentes telas.
Antiséptico
Sirve como antiséptico, siendo eficaz para evitar las infecciones de la piel. En algunos momentos, se utilizó en fumigaciones para desinfectar barcos, pertenencias de víctimas de epidemias, etc.
Agente conservante
Se utiliza el ácido sulfuroso como conservante de las frutas y los vegetales y para evitar la fermentación de bebidas como el vino y la cerveza, siendo un elemento antioxidante, antibacteriano y fungicida.
Productos químicos
El ácido sulfuroso se utiliza en la síntesis de medicamentos y productos químicos, en la elaboración del vino y de la cerveza, en el refinamiento de productos derivados del petróleo, y como reactivo analítico.
Referencias
- Nomenclature of acids. Recuperado de 2.chemistry.gatech.edu
- Calvo Flores, F. G. Formulación de química inorgánica. Recuperado de ugr.es
