Nitrato de bario: estructura química, usos, propiedades
El nitrato de bario es una sal compuesta por un átomo de bario (Ba) y el ión nitrato (NO3). Se presenta como un sólido cristalino blanco a temperatura ambiente y existe en la naturaleza como un mineral muy raro conocido como la nitrobarita. Sus propiedades lo convierten en un compuesto tóxico que debe ser manejado cuidadosamente.
De hecho, este compuesto tiene múltiples usos en la industria militar, ya que puede ser unido a otras sustancias químicas y añadido a las formulaciones de explosivos e incendiarios, entre otros.

Índice del artículo
- 1 Fórmula
- 2 Estructura química del nitrato de bario
- 3 Disociación
- 4 Usos del nitrato de bario
- 5 Propiedades físicas y químicas
- 6 Referencias
El nitrato de bario, también llamado dinitrato de bario, posee la fórmula química Ba(NO3)2, y suele ser fabricado a través de dos métodos.
El primero de estos involucra la disolución de pequeños trozos de carbonato de bario (BaCO3) en un medio de ácido nítrico (HNO3, un ácido mineral altamente corrosivo), permitiendo que luego las impurezas de hierro se precipiten y que después esta mezcla sea filtrada, evaporada y cristalizada.
El segundo método se realiza a través de la combinación de cloruro de bario (BaCl2, una de las sales de bario de mayor solubilidad en el agua) con una solución precalentada de nitrato de sodio. Esto genera una reacción que resulta en la separación de cristales de nitrato de bario de la mezcla.
Esta sal presenta características de estructura cristalina cúbica u octaedros anhidros.
Su estructura química es la siguiente:
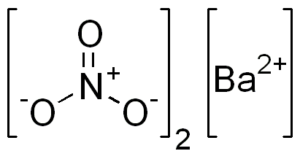
A temperaturas elevadas (592 ºC), el nitrato de bario se descompone para formar óxido de bario (BaO), dióxido de nitrógeno (NO2) y oxígeno (O2), de acuerdo con la siguiente reacción química:
2Ba(NO3)2 + Calor → 2BaO + 4NO2 +O2
En medios con altas concentraciones de óxido nítrico (NO), la descomposición del nitrato de bario produce un compuesto llamado nitrito de bario (Ba(NO2)2), según la siguiente ecuación:
Ba(NO3)2 + 2NO → Ba(NO2)2 + 2NO2
Las reacciones con sulfatos solubles de metal o ácido sulfúrico (H2SO4) generan sulfato de bario (BaSO4). La gran mayoría de las sales de bario insolubles, como el carbonato (BaCO3), oxalato (BaC2O4) o fosfato del metal (Ba3(PO4)2), son precipitados por reacciones similares de doble descomposición.
Esta sustancia en forma de polvo es un agente oxidante y reacciona de manera significativa con los agentes reductores comunes.
Cuando esta sal es mezclada con otros metales, como por ejemplo el aluminio o el zinc en sus formas finamente divididas, o con aleaciones como el aluminio-magn0esio, se enciende y explota al impacto. Por esta razón, el nitrato de bario es considerado un excelente componente de armas y explosivos de uso militar.
Unido con el trinitrotolueno (comercialmente conocido como el TNT, o C6H2(NO2)3CH3) y un aglutinante (regularmente la cera de parafina), esta sal forma un compuesto llamado Baratol, el cual tiene propiedades explosivas. La alta densidad del nitrato de bario hace que el Baratol adquiera también una densidad mayor, haciéndolo más efectivo en su función.
El nitrato de bario también se une con el polvo de aluminio, una fórmula que resulta en la formación de la pólvora destellante, la cual es usada principalmente en fuegos artificiales y pirotecnia teatral.
Esta pólvora destellante además ha visto usos en la producción de bengalas (como medidas antimisiles de los aviones) y en granadas aturdidoras. Además, esta sustancia es altamente explosiva.
Esta sal es combinada con la mezcla reactante llamada termita para formar una variación de esta llamada termate, que genera cortos y muy poderosos destellos de altísimas temperaturas en áreas pequeñas durante poco tiempo.
El termate-TH3 es un termate que contiene un 29 % de composición en peso de nitrato de bario, que ayuda a incrementar el efecto térmico, generar llamas y reducir significativamente la temperatura de ignición del termate.
Los termates suelen ser utilizados en la producción de granadas incendiarias y tienen la función de destruir armadura de tanques y estructuras militares.
Además, el nitrato de bario fue uno de los ingredientes más usados en la producción de cargas incendiarias utilizadas por los británicos en sus aviones de guerra durante la Segunda Guerra Mundial, los cuales armaban con municiones incendiarias que servían para destruir aviones enemigos.
Finalmente, esta sal tiene usos en el proceso de manufacturación del óxido de bario, en la industria de las válvulas termoiónicas y, como ya se dijo, en la creación de pirotecnia, especialmente aquellas de colores verdes.

La sal se presenta como un sólido blanco, higroscópico e inodoro, el cual es poco soluble en agua y totalmente insoluble en alcoholes.
Posee una masa molar de 261,337 g/mol, una densidad de 3,24 g/cm3 y un punto de fusión de 592 ºC. Al llegar a su punto de ebullición se descompone, como se ha dicho anteriormente. A temperatura ambiente posee una solubilidad en el agua de 10,5 g/100 ml.
Se considera estable, pero es un fuerte agente oxidante y debe ser alejado de materiales combustibles para evitar incendios. Tiene sensibilidad al agua y no debe ser mezclado con ácidos ni anhidros.
En concentraciones altas (por ejemplo, contenedores) deben ser aislados de sustancias que puedan hacerlo reaccionar, ya que puede explotar de manera violenta.
Como cualquier otro compuesto soluble del bario, es una sustancia tóxica para animales y seres humanos.
No debe ser inhalado ni consumido, ya que pueden presentarse síntomas de envenenamiento (especialmente endurecimiento de los músculos faciales), vómitos, diarrea, dolores abdominales, temblores musculares, ansiedad, debilidad, dificultad respiratoria, irregularidad cardíaca y convulsiones.
Puede ocurrir la muerte a raíz de un envenenamiento con esta sustancia, a pocas horas o pocos días de presentarse.
La inhalación del nitrato de bario genera irritación en la mucosa respiratoria y, en ambos modos de envenenamiento, deben prepararse soluciones de sales de sulfato para aplicar primeros auxilios al afectado.
En caso de derrames, debe ser aislada de sustancias y materiales combustibles y, en casos de incendio, nunca debe entrar en contacto con químicos secos o espumas. El área debe ser inundada con agua si el incendio es de mayor tamaño.
- Mabus. (s.f.). ScienceMadness. Obtenido de sciencemadness.org
- United States Incendiary Bomb TH3-M50A3. (s.f.). Obtenido de ammunitionpages.com
- Cameo Chemicals. (s.f.). Obtenido de cameochemicals.noaa.gov
- Chemspider. (s.f.). Obtenido de chemspider.com
