Hexosa: características, funciones, derivados
Una hexosa es un carbohidrato que tiene seis átomos de carbono y cuya fórmula empírica es C6H12O6. Los carbohidratos o sacáridos (del griego, sakcharon = azúcar) son polihidroxi-aldehídos o polihidroxi-cetonas.
En la naturaleza, el monosacárido más abundante es la glucosa, un azúcar de seis carbonos, también denominado dextrosa. La biosíntesis de glucosa tiene lugar a partir de dióxido de carbono y agua mediante la fotosíntesis.
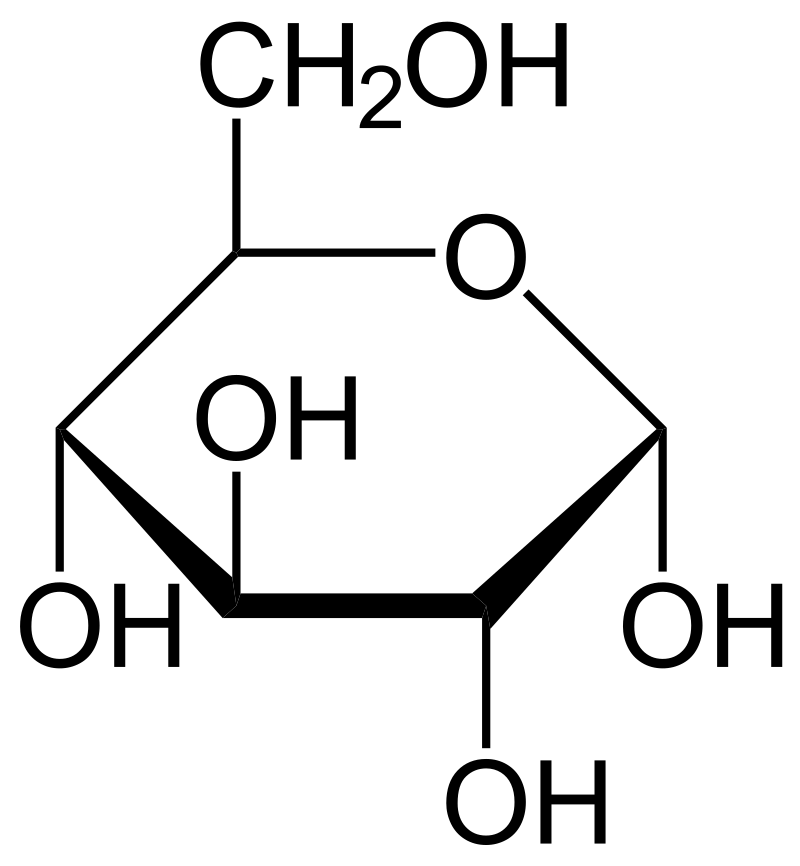
En las plantas, a partir de la glucosa, ocurre la síntesis de celulosa, un polisacárido estructural, y de almidón, un polisacárido de reserva. En los organismos heterótrofos, la oxidación de glucosa es la vía metabólica central para la producción de energía.
Índice del artículo
- 1 Características
- 2 Derivados de hexosas
- 3 Hexosas más comunes en la naturaleza y sus funciones
- 4 Referencias
Las hexosas pueden ser de dos tipos: 1) aldosas (o aldohexosas), en las cuales el carbono 1 (C-1) es una función aldehído; o 2) cetosas (o aldocetosas) en las cuales el carbono 2 (C-2) es una función ceto. El resto de los carbonos son alcoholes secundarios o primarios.
En las aldohexosas todos los carbonos son quirales, excepto el carbono 1 (C-1) y el carbono 6 (C-6), es decir tienen cuatro centros asimétricos. En las cetohexosas hay tres centros asimétricos, que son C-3, C-4 y C-5.
En la naturaleza, los azúcares tales como las hexosas con la configuración L, son menos abundantes que los azúcares con la configuración D.
La función aldehído o la función ceto de las hexosas reacciona con un grupo hidroxilo secundario, en una reacción intramolecular, para formar hemiacetales o hemicetales cíclicos. Los azúcares cíclicos con seis miembros son piranosas y los de cinco miembros son furanosas.
En el azúcar cíclico, el carbono carbonilo de los grupos aldehído y ceto se convierte en un nuevo centro quiral, denominado carbono anomérico. La configuración de este carbono puede ser alfa o beta, es decir produce dos anómeros.
Los seis átomos que conforman las piranosas no son planares sino que tienen dos conformaciones tipo silla en la cual los sustituyentes voluminosos ocupan: a) posiciones ecuatoriales o b) posiciones axiales. Estas conformaciones pueden interconvertirse sin romper los enlaces covalentes.
Las interacciones estereoquímicas entre los sustituyentes del anillo influencian la estabilidad relativa de estas conformaciones. Así, la conformación más estable es aquella en la cual el grupo más voluminoso ocupa una posición ecuatorial.
La reactividad química de un determinado grupo es influenciada por su ubicación conformacional. Un ejemplo es el grupo hidroxilo (-OH) que cuando ocupa la posición ecuatorial, es más fácilmente esterificado que cuando ocupa la posición axial.
La β-D-glucosa, una aldohexosa, tiene todos los sustituyentes en posición ecuatorial, lo cual los hace más susceptibles a la esterificación. Esta reacción es importante para la formación de enlaces covalentes entre azúcares. Esto podría explicar por qué la β-D-glucosa es el azúcar más abundante en la naturaleza.
Las unidades de monosacáridos, como las hexosas, pueden unirse covalentemente mediante enlaces O-glicosídicos formados cuando el carbono anomérico de una molécula de azúcar reacciona con el grupo hidroxilo de otra molécula de azúcar. El resultado de esta reacción es la formación de un acetal a partir de un hemiacetal.
Un ejemplo es la reacción del C-1, carbono anomérico de la α-D-glucopiranosa con el grupo hidroxilo del C-4 de otro β-D-glucopiranosa. De ella se forma α-D-glucopiranosil-(1®4)-D-glucopiranosa.
La reacción de formación de enlaces glicosídicos implica la eliminación de una molécula de agua, denominada reacción de condensación. La reacción inversa es la hidrólisis y ruptura del enlace glicosídico.
Los azúcares cuyo átomo de carbono anomérico no ha formado enlaces glicosídicos son denominados azúcares reductores. Todos los monosacáridos, como las hexosas glucosa, manosa y galactosa, son azúcares reductores. Esto se debe a que las aldosas o cetosas pueden donar electrones, o reducir, a un agente oxidante.
Una prueba clásica de los azúcares reductores se realiza con los reactivos de Fehling (o Benedict) y Tollens. Por ejemplo, un azúcar reductor puede reducir Ag+ presente en una solución de amonio (el reactivo de Tollens). Esta reacción produce plata metálica en el fondo del recipiente donde tuvo lugar la reacción.
Mediante una reacción catalizada por la enzima glucosa oxidasa, el carbono anomérico de la D-glucosa es oxidado perdiendo un par electrones, y el oxígeno es reducido recibiendo un par de electrones. Esta reacción tiene dos productos: el D-glucono-d-lactona y peróxido de hidrógeno.
En la actualidad, la concentración de glucosa de la sangre se determina mediante una prueba que emplea la glucosa oxidasa y la peroxidasa. Esta ultima enzima cataliza una reacción de oxidación-reducción.
Los sustratos de la peroxidasa son el peróxido de hidrógeno y una sustancia cromogénica, la cual es oxidada. Esta reacción puede ser cuantificada usando un espectrofotómetro.
Hay muchos derivados de hexosas cuyo grupo hidroxilo es reemplazado por otro sustituyente. Por ejemplo, el grupo hidroxilo del C-2 de la glucosa, galactosa y manosa es reemplazado con un grupo amino, formando glucosamina, galactosamina y manosamina, respectivamente.
Frecuentemente, el grupo amino condensa con ácido acético, formando N-acetilglucosamina. Este derivado de la glucosamina se encuentra en la pared celular de las bacterias.
Un derivado de la N-acetilmanosamina es el ácido N-acetilneuramínico, conocido como ácido siálico. Este último está presente en las glicoproteínas y los glicolípidos en la superficie de las células, teniendo un papel en el reconocimiento por otras células.
La oxidación específica del grupo de alcohol primario, C-6, de las aldohexosas glucosa, galactosa y manosa produce ácidos urónicos. Estos productos son ácido D-glucorónico, ácido D-galacturónico y D-ácido manurónico, que forman parte de muchos polisacáridos.
Los ácidos urónicos pueden experimentar una esterificación intramolecular. Forma lactonas de cinco o seis átomos. Por ejemplo, el ácido ascórbico (vitamina C) es sintetizado por las plantas.
La sustitución del grupo hidroxilo (-OH) por un átomo de hidrógeno en el C-6 de la L-galactosa o de la L-manosa produce L-fucosa o L-ramnosa, respectivamente. La L-fucosa se encuentra en glicoproteínas y glicolípidos. La L-ramnosa se encuentra en los polisacáridos en las plantas.
Símbolo: Glc. Es una aldohexosa o glucohexosa. El enantiómero D-glucosa (símbolo D-Glu) es más común que el enantiómero L-Glc. D-Glc está presente en plantas, miel, uvas y en la sangre de los animales. Es fuente de energía para los seres vivos. Sirve como precursor para la síntesis de glicógeno, celulosa, almidón y lactosa.
Símbolo: Fru. Es una cetohexosa o fructohexosa. El enantiómero D-fructosa, es conocido comúnmente como fructosa. Este azúcar se encuentra, por ejemplo, en las frutas, la miel y en el semen.
Símbolo Gal. Es una aldohexosa o galatohexosa. La D-galactosa es más común que L-galactosa. La D-galactosa es el azúcar del cerebro o cerebrosa. Rara vez se encuentra libre. Por lo general se encuentra en las plantas, animales y microorganismos en la forma de oligosacáridos y polisacáridos.
Símbolo: Man. Es una aldohexosa o manohexosa. La forma D-manosa está ampliamente distribuida en el mana y la hemicelulosa. Se encuentra como un oligosacárido N-unido a las glicoproteínas, formando ramificaciones.
Símbolo: Rha. Es una aldohexosa que se encuentra en los glicósidos de las plantas, en los polisacáridos de gomas y mucílagos, así como en la pared celular de plantas y en los flavonoides.
- Cui, S. W. 2005. Food carbohydrates: chemistry, physical properties, and applications. CRC Press, Boca Raton.
- Nelson, D. L., Cox, M. M. 2017. Lehninger principles of biochemistry. W. H. Freeman, Nueva York.
- Rastall, R. A. 2010. Functional oligosaccharides: application and manufacture. Annual Review of Food Science and Technology, 1, 305–339.
- Sinnott, M. L. 2007. Carbohydrate chemistry and biochemistry structure and mechanism. Royal Society of Chemistry, Cambridge.
- Stick, R. V., Williams, S. J. 2009. Carbohydrates: the essential molecules of life. Elsevier, Amsterdam.
- Tomasik, P. 2004. Chemical and functional properties of food saccharides. CRC Press, Boca Raton.
- Voet, D., Voet, J. G., Pratt, C. W. 2008. Fundamentals of biochemistry – life at the molecular level. Wiley, Hoboken.
