Fenolftaleína (C20H14O4): estructura química, propiedades, usos, síntesis
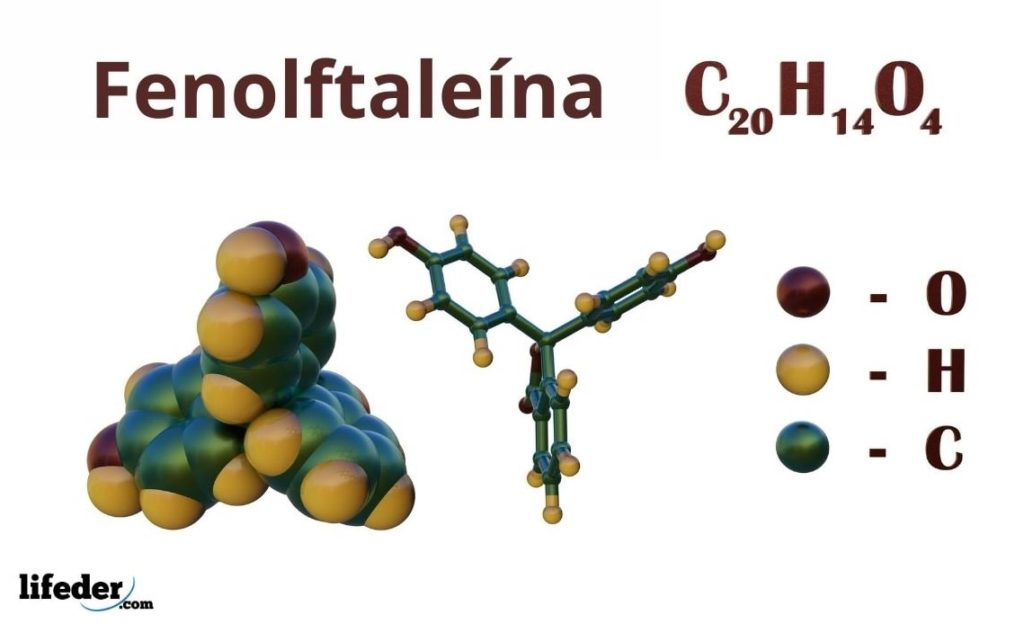
¿Qué es la fenolftaleína?
La fenolftaleína es un colorante orgánico, el cual es a su vez un ácido débil diprótico, usado en muchas determinaciones volumétricas como indicador ácido-base. Es decir, si es un ácido diprótico, en solución puede perder dos iones H+, y para ser un indicador debe tener la propiedad de ser colorido en el rango de pH que se está valorando.
En medio básico (pH>8) la fenolftaleína es de color rosado, el cual puede intensificarse hasta un rojo violáceo. Para ser utilizado como indicador ácido-base no debe reaccionar con mayor rapidez con los OH– del medio que los analitos a determinar.
Además, como es un ácido muy débil la presencia de los grupos –COOH queda descartada y, por tanto, la fuente de los protones ácidos son dos grupos OH enlazados a dos anillos aromáticos.
Fórmula
La fenolftaleína es un compuesto orgánico cuya fórmula química condensada es C20H14O4. Aunque quizás no sea suficiente para descubrir qué grupos orgánicos posee, a partir de la fórmula se pueden calcular las insaturaciones, para así empezar a dilucidar su esqueleto.
Estructura química
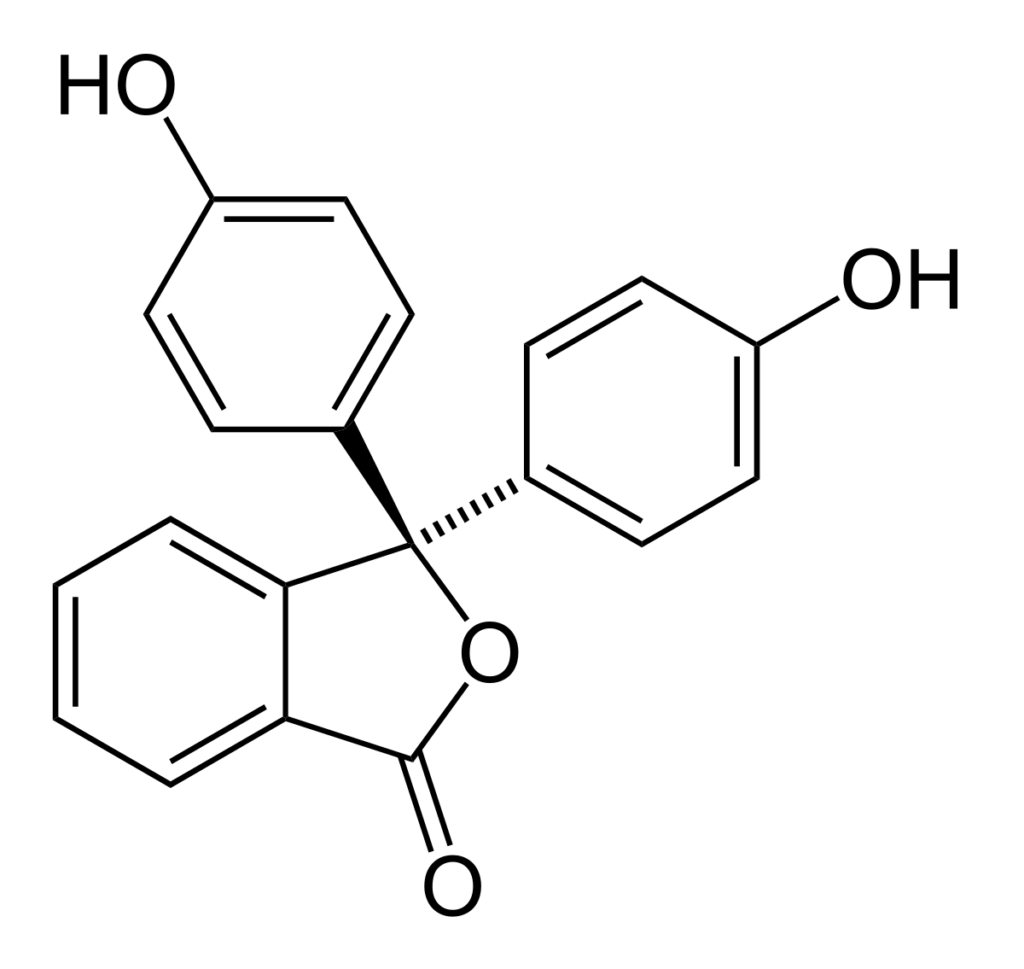
La estructura de la fenolftaleína es dinámica, lo que significa que sufre cambios dependiendo del pH de su entorno. En la imagen superior está ilustrada la estructura de la fenolftaleína en el rango de 0
Es el anillo pentagonal el que sufre las mayores modificaciones. Por ejemplo, en medio básico, al desprotonarse uno de los grupos OH de los anillos fenólicos, su carga negativa (-O–) es atraída por el anillo aromático, “abriendo” el anillo pentagonal en el nuevo arreglo de sus enlaces.
Aquí, la nueva carga negativa está localizada en el grupo –COO–, el cual “se desprendió” del anillo pentagonal.
Luego, tras aumentar la basicidad del medio, se desprotona el segundo grupo OH de los anillos fenólicos y la carga resultante se deslocaliza por toda la estructura molecular.
La imagen inferior resume el resultado de las dos desprotonación en medio básico. Es esta estructura la responsable de la coloración rosada tan familiar de la fenolftaleína.
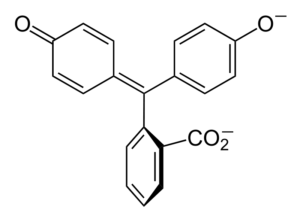
Los electrones que “viajan” por el sistema π conjugado (representado con los dobles enlaces resonantes) absorben en el espectro visible, específicamente a la longitud de onda del color amarillo, reflejando el color rosado que llega a los ojos del expectador.
La fenolftaleína tiene en total cuatro estructuras. Las dos anteriores son las más importantes en términos prácticos y se representan abreviadamente como: H2In y In2-.
Usos/aplicaciones de la fenolftaleína

Función de indicador
La fenolftaleína es usada en análisis químicos como un indicador visual en la determinación del punto de equivalencia en las reacciones de neutralización o titulaciones ácido-base. El reactivo para estas valoraciones ácido-base se prepara al 1% disuelta en alcohol de 90 %.
La fenolftaleína presenta 4 estados:
- En un medio fuertemente ácido presenta una coloración naranja (H3In+).
- Al aumentar el pH y hacerse ligeramente básico, la solución se torna incolora (H2In).
- En la forma aniónica al perder el segundo protón, se genera un cambio de color en la solución de incoloro a rojo violáceo (In2-), esto como consecuencia del aumento de pH entre 8,0 a 9,6.
- En un medio fuertemente básico (pH>13), la coloración es incolora (In(OH)3-).
Este comportamiento ha permitido el uso de la fenolftaleína como un indicio de la carbonación del concreto, el cual hace variar el pH a un valor entre 8,5 a 9.
Asimismo, el cambio de coloración es muy brusco; es decir, que el anión In2- rosado se produce a gran velocidad. En consecuencia, esto le permite ser un candidato como indicador en muchas determinaciones volumétricas; por ejemplo, la de un ácido débil (ácido acético) o fuerte (ácido clorhídrico).
Usos en medicina
La fenolftaleína se usó como agente laxativo. Sin embargo, existe una literatura científica indicativa de que algunos laxantes que contienen como principio activo la fenolftaleína —que actúa inhibiendo la absorción de agua y electrolitos en el intestino grueso promoviendo las evacuaciones— podrían tener efectos negativos.
El uso prolongado de estos medicamentos que contienen fenolftaleína se encuentra asociado a la producción de varios trastornos en el funcionamiento intestinal, pancreatitis e incluso cáncer, producidos principalmente en mujeres y en los modelos animales utilizados para el estudio farmacológico de este compuesto químico.
La fenolftaleína modificada químicamente, para luego transformarla en su estado reducido, es usada como reactivo en las pruebas forenses que permiten determinar la presencia de la hemoglobina en una muestra (prueba de Kastle-Meyer), que no es concluyente por la presencia de falsos positivos.
Síntesis de la fenolftaleína
Se forma de la condensación del anhídrido ftálico con el fenol, en presencia de ácido sulfúrico concentrado, y de una mezcla cloruros de aluminio y de zinc como catalizadores de la reacción:
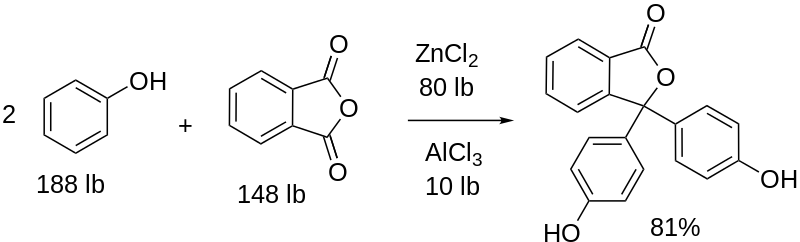
La sustitución electrofílica aromática es el mecanismo que rige esta reacción. ¿En qué consiste? El anillo fenólico (la molécula de la izquierda) está cargado negativamente gracias al átomo de oxígeno rico en electrones, el cual es capaz de hacer que cualquier par libre de ellos recorra “el circuito electrónico” del anillo.
Por otro lado, el carbono del grupo C=O del anhídrido ftálico está muy desprotegido, debido a que el anillo ftálico y los átomos de oxígeno le sustraen densidad electrónica, llevando así una carga parcial positiva. El anillo fenólico, rico en electrones, ataca a este carbono pobre en electrones, incorporándose el primer anillo a la estructura.
Este ataque ocurre preferencialmente en el extremo opuesto del carbono enlazado al grupo OH; esta es la posición –para.
Lo mismo ocurre con el segundo anillo: ataca al mismo carbono y de este se libera una molécula de agua generada gracias al medio ácido.
De este modo, la fenolftaleína no es más que una molécula de anhídrido ftálico que ha incorporado dos anillos fenólicos en uno de sus grupos carbonillos (C=O).
Propiedades de la fenolftaleína
Su aspecto físico es el de un sólido blanco con cristales triclínicos, a menudo aglomerados o en forma de agujas rómbicas. Es inodoro, más denso que el agua líquida (1,277 g/mL a 32 ºC), y muy poco volátil (presión de vapor estimada: 6,7 x 10-13 mmHg).
Es muy poco soluble en agua (400 mg/l), pero muy soluble en alcoholes y éter. Por esta razón se recomienda diluirlo en etanol antes de ser empleado.
Es insoluble en solventes aromáticos como benceno y tolueno, o en hidrocarburos alifáticos como n-hexano.
Funde a 262,5 ºC y el líquido tiene un punto de ebullición de 557,8±50,0 ºC a la presión atmosférica. Estos valores son indicativos de las fuertes interacciones intermoleculares. Esto es debido a los puentes de hidrógeno, así como a las interacciones frontales entre los anillos.
Su pKa es de 9,7 a 25 ºC. Esto se traduce en una tendencia muy baja para disociarse en medio acuoso:
H2In(ac) + 2H2O(l) => In2-(ac) + 2H3O+
Este es un equilibrio en medio acuoso. Sin embargo, el aumento de los iones OH– en la solución disminuye la cantidad presente de H3O+.
Consecuentemente, el equilibrio se desplaza a la derecha, para producir más H3O+. De este modo se recompensa su pérdida inicial.
A medida que se agrega más base, el equilibrio sigue desplazándose hacia la derecha, y así sucesivamente hasta no quedar nada de la especie H2In. En este punto, la especie In2- colorea de rosado la solución.
Por último, la fenolftaleína se descompone al calentarse, emitiendo un humo acre e irritante.
Referencias
- Fitzgerald, Lawrence J.; Gerkin, Roger E. Acta Crystallographica Section C (1998) 54, 535-539. Recuperado de crystallography-online.com
- Herrera D., Fernández c. et al (2015). Laxantes con fenolftaleína y su relación con el desarrollo de cáncer. Recuperado de uv.mx
- Pan Reac AppliChem. (2015). Recuperado de applichem.com
- Wikipedia. (2018). Phenophthalein. Recuperado de en.wikipedia.org
