Nitrato de potasio (KNO3): estructura, propiedades, usos, síntesis
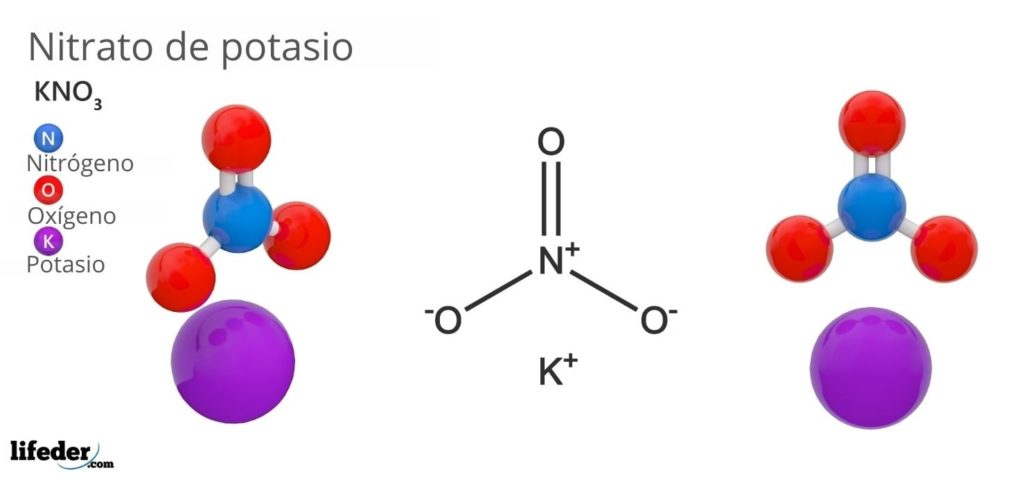
¿Qué es el nitrato de potasio?
El nitrato de potasio es una sal ternaria compuesta de potasio, metal alcalino, y del oxoanión nitrato. Su fórmula química es KNO3, lo que significa que por cada ion K+, hay un ion NO3- interaccionando con este. Por lo tanto, es una sal iónica y constituye uno de los nitratos alcalinos (LiNO3, NaNO3, RbNO3…).
El KNO3 es un agente oxidante fuerte debido a la presencia del anión nitrato. Es decir, funciona como reserva de iones nitratos sólidos y anhídros, a diferencia de otras sales altamente solubles en agua o muy higroscópicas. Muchas de las propiedades y usos de este compuesto se deben al anión nitrato, más que al catión potasio.
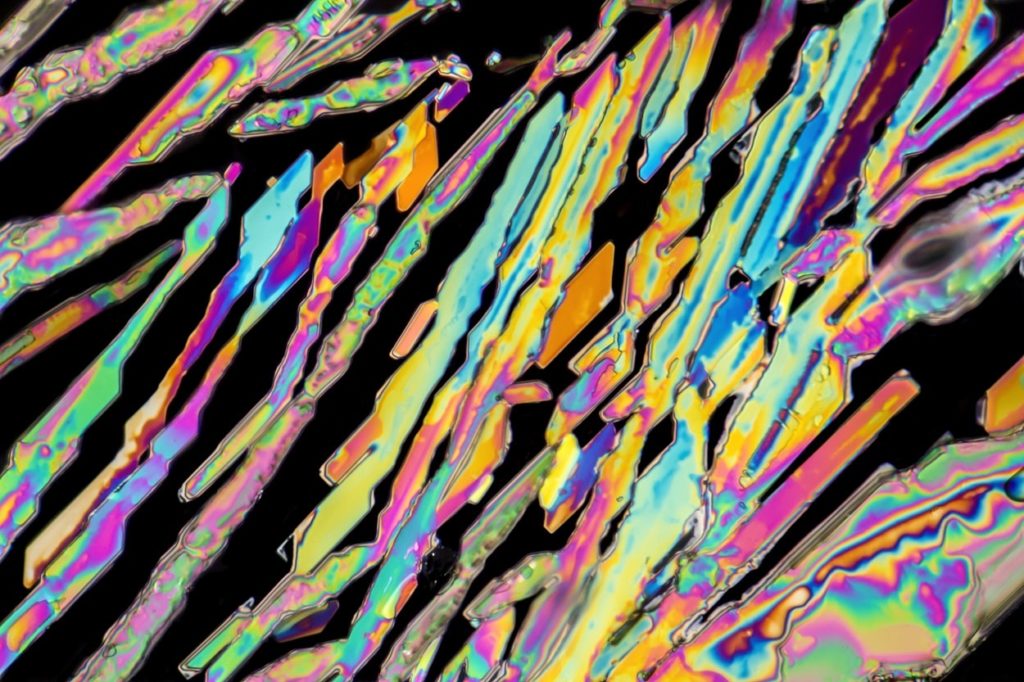
En la imagen superior se ilustran unos cristales de KNO3 con formas de agujas. La fuente natural del KNO3 es el salitre, conocido con los nombres Saltpeter o salpetre, en inglés. Este elemento se conoce también como nitrato de potasa o mineral nitro.
Se encuentra en zonas áridas o desérticas, así como eflorescencias de las paredes cavernosas. Otra fuente importante de KNO3 es el guano, excremento de animales que habitan ambientes secos.
Estructura química del nitrato de potasio
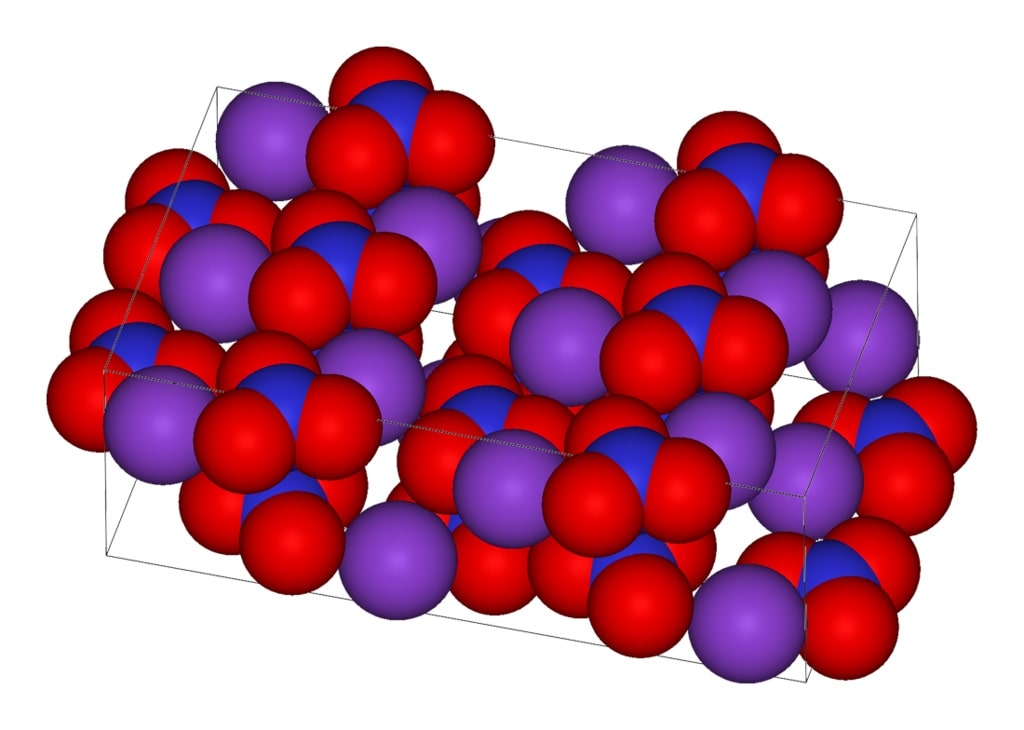
En la imagen superior está representada la estructura cristalina del KNO3. Las esferas púrpuras corresponden a los iones K+, mientras que las rojas y azules son los átomos de oxígeno y nitrógeno, respectivamente. La estructura cristalina es de tipo ortorrómbica a temperatura ambiente.
La geometría del anión NO3– es la de un plano trigonal, con los átomos de oxígeno en los vértices del triángulo, y el átomo de nitrógeno en su centro. Presenta una carga formal positiva en el átomo de nitrógeno, y dos cargas formales negativas en dos átomos de oxígeno (1-2= (-1)).
Estas dos cargas negativas del NO3– se deslocalizan entre los tres átomos de oxígeno, manteniendo siempre la carga positiva en el nitrógeno. Como consecuencia de lo anterior, los iones K+ del cristal evitan situarse justo por encima o por debajo del nitrógeno de los aniones NO3–.
De hecho, la imagen demuestra cómo los iones K+ están rodeados de los átomos de oxígeno, las esferas rojas. En conclusión, estas interacciones son responsables de los arreglos cristalinos.
Otras fases cristalinas
Variables como la presión y la temperatura pueden modificar estos arreglos y originar distintas fases estructurales para el KNO3 (fases I, II y III). Por ejemplo, la fase II es la de la imagen, mientras que la fase I (con estructura cristalina trigonal) se forma cuando los cristales son calentados hasta 129 ºC.
La fase III es un sólido transicional que se obtiene del enfriamiento de la fase I, y algunos estudios han demostrado que exhibe algunas propiedades físicas importantes, como la ferroelectricidad. En esta fase el cristal forma capas de potasio y nitratos, sensibles posiblemente a las repulsiones electrostáticas entre los iones.
En las capas de la fase III los aniones NO3– pierden un poco de su planaridad (el triángulo se curva ligeramente) para permitir este arreglo, el cual, ante cualquier disturbio mecánico, se convierte en la estructura de la fase II.
Usos/aplicaciones del nitrato de potasio
La sal es de gran importancia, ya que se usa en numerosas actividades del hombre, que se manifiestan en la industria, la agricultura, los alimentos, etc. Entre estos usos destacan los siguientes:
- La preservación de los alimentos, especialmente de la carne. A pesar de la sospecha de que interviene en la formación de la nitrosamina (agente carcinogénico) se sigue utilizando en charcutería.
- Fertilizante, porque el nitrato de potasio aporta dos de los tres macronutrientes de las plantas: el nitrógeno y el potasio. Junto con el fósforo, este elemento es necesario para el desarrollo de las plantas. Es decir, es una reserva importante y manejable de estos nutrientes.
- Acelera la combustión, pudiendo producir explosiones si el material combustible es extenso o si está finamente dividido (mayor área superficial, mayor reactividad). Además, es uno de los principales componentes de la pólvora.
- Facilita la remoción de los tocones de los árboles talados. El nitrato suministra el nitrógeno necesario para que los hongos destruyan la madera de los tocones.
- Interviene en la reducción de la sensibilidad dental mediante su incorporación en dentífricos, lo cual incrementa la protección a las sensaciones dolorosas del diente producidas por frío, calor, ácido, dulces o contacto.
- Interviene como hipotensor en la regulación de la presión arterial en humanos. Este efecto estaría dado o interrelacionado con un cambio en la excreción de sodio. La dosis recomendada en el tratamiento es de 40-80 mEq/día de potasio. Al respecto se señala que el nitrato de potasio tendría acción diurética.
Síntesis
La mayor parte del nitrato es producido en las minas de los desiertos en Chile. Puede ser sintetizado mediante varias reacciones:
NH4NO3 (ac) + KOH(ac) => NH3 (ac) + KNO3 (ac) + H2O(l)
También se produce el nitrato de potasio neutralizando el ácido nítrico con hidróxido de potasio en una reacción altamente exotérmica.
KOH (ac) + HNO3(conc) => KNO3 (ac) + H2O (l)
A escala industrial, se produce nitrato de potasio mediante una reacción de doble desplazamiento.
NaNO3 (ac) + KCl (ac) => NaCl (ac) + KNO3 (ac)
La fuente principal del KCl es del mineral silvina, y no de otros minerales como la carnalita o la cainita, los cuales están compuestos también de magnesio iónico.
Propiedades físicas y químicas
El nitrato de potasio en estado sólido se presenta como un polvo blanco o en forma de cristales de estructura ortorómbica a temperatura ambiental, y trigonal a 129 ºC. Tiene un peso molecular de 101,1032 g/mol, es inodoro y tiene un sabor acre salino.
Es un compuesto muy soluble en agua (316-320 g/litro de agua, a 20 ºC), debido a su naturaleza iónica y a la facilidad que tienen las moléculas de agua para solvatar el ión K+.
Su densidad es de 2,1 g/cm3 a 25 ºC. Esto significa que es aproximadamente dos veces más denso que el agua.
Sus puntos de fusión (334 ºC) y de ebullición (400 ºC) son indicativos de los enlaces iónicos entre K+ y NO3–. Sin embargo, son bajos comparados a los de otras sales, debido a que la energía reticular cristalina es menor para iones monovalentes (esto es, con cargas ±1), y además tienen tamaños no muy similares.
Se descompone a una temperatura cercana al punto de ebullición (400 ºC) para producir nitrito de potasio y oxígeno molecular:
KNO3(s) => KNO2(s) + O2(g)
Referencias
- Pubchem. (2018). Potassium Nitrate. Recuperado de pubchem.ncbi.nlm.nik.gov
- Acta Cryst. (2009). Growth and single-crystal refinement of phase-III potassium nitrate, KNO3. B65, 659–663.
- Marni Wolfe. (03 de octubre de 2017). Potassium Nitrate Risks. Recuperado de livestrong.com
- Amethyst Galleries, Inc. (1995-2014). The mineral niter. Recuperado de galleries.com
