Experimento de Rutherford: historia, descripción y conclusiones
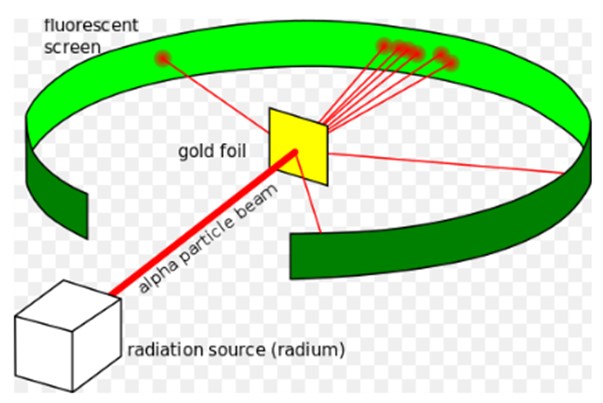
El experimento de Rutherford, llevado a cabo entre 1908 y 1913, consistió en bombardear una delgada lámina de oro de 0.0004 mm de espesor, con partículas alfa y analizar el patrón de dispersión que dichas partículas dejaban sobre una pantalla fluorescente.
En realidad, Rutherford realizó numerosos experimentos, refinando los detalles cada vez más. Tras analizar cuidadosamente los resultados, dos conclusiones importantísimas se pusieron de manifiesto:
-La carga positiva del átomo está concentrada en una región denominada núcleo.
-Este núcleo atómico es increíblemente pequeño en comparación con el tamaño del átomo.
Ernest Rutherford (1871-1937) era un físico nacido en Nueva Zelanda, cuyo campo de interés eran la radiactividad y la naturaleza de la materia. La radiactividad era un fenómeno reciente cuando Rutherford comenzó sus experimentos, había sido descubierta por Henri Becquerel en 1896.
En 1907 Rutherford se trasladó a la Universidad de Manchester en Inglaterra para estudiar la estructura del átomo, utilizando estas partículas alfa como sondas para escudriñar el interior de tan diminuta estructura. Le acompañaban en la tarea los físicos Hans Geiger y Ernest Marsden.
Ellos albergaban la esperanza de poder ver cómo una partícula alfa, que es un átomo de helio doblemente ionizado, interactuaba con un átomo de oro único, para asegurarse de que cualquier desviación que aquella experimentara se debiera solamente a la fuerza eléctrica.
Sin embargo, la mayor parte de las partículas alfa atravesaba la lámina de oro sufriendo apenas una pequeña desviación.
Este hecho estaba en total acuerdo con el modelo atómico de Thomson, no obstante, para sorpresa de los investigadores, un pequeño porcentaje de las partículas alfa experimentaba una desviación bastante notable.
Y un porcentaje aún más pequeño de partículas se regresaba, rebotando completamente hacia atrás. ¿A qué se debían estos resultados inesperados?
Índice del artículo
- 1 Descripción y conclusiones del experimento
- 2 Influencias en el modelo del átomo
- 3 ¿Cómo es un modelo a escala del átomo de hidrógeno?
- 4 El modelo atómico en la actualidad
- 5 Referencias
De hecho, las partículas alfa que Rutherford utilizó a modo de sonda, son núcleos de helio, y en ese entonces solo se sabía que dichas partículas tenían carga positiva. Hoy día se conoce que las partículas alfa se componen de dos protones y dos neutrones.
Las partículas alfa y las partículas beta habían sido identificadas por Rutherford como dos diferentes clases de radiación provenientes del uranio. Las partículas alfa, mucho más masivas que el electrón, tienen carga eléctrica positiva, mientras que las partículas beta pueden ser electrones o positrones.
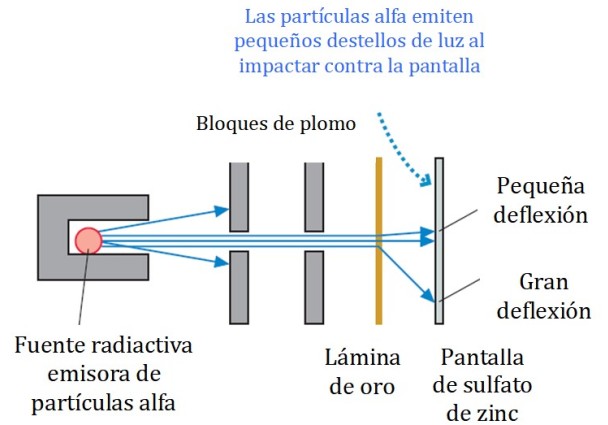
En la figura 2 se muestra un esquema simplificado del experimento. El haz de partículas alfa proviene de una fuente radiactiva. Geiger y Marsden utilizaron el gas radón como emisor.
Los bloques de plomo se utilizaron para dirigir la radiación hacia la lámina de oro y evitar que fueran a parar directamente a la pantalla fluorescente. El plomo es un material que absorbe la radiación.
Seguidamente el haz así dirigido, se hacía incidir sobre una delgada lámina de oro y la mayor parte de las partículas sigue su camino hacia la pantalla fluorescente de sulfato de zinc, donde dejaban una pequeña huella luminosa. Geiger se encargó de contarlas una por una, aunque luego diseñaron un dispositivo que lo hacía.
El hecho de que algunas partículas experimentaran una pequeña deflexión no sorprendió a Rutherford, Geiger y Marsden. Después de todo, en el átomo hay cargas positivas y negativas que ejercen fuerzas sobre las partículas alfa, pero como el átomo es neutro, cosa que ellos ya sabían, las desviaciones debían ser pequeñas.
La sorpresa del experimento es que unas pocas partículas positivas eran rebotadas casi directamente hacia atrás.
Alrededor de 1 en 8000 partículas alfa experimentaban deflexión en ángulos mayores a 90º. Pocas, pero suficientes para cuestionar algunas cosas.
El modelo atómico en boga era el de pudín de pasas de Thomson, antiguo profesor de Rutherford en el Laboratorio Cavendish, pero este se preguntó si la idea de un átomo sin núcleo y con los electrones incrustados como pasas, era correcta.
Porque resulta que estas grandes deflexiones de las partículas alfa y el hecho de que algunas pocas sean capaces de devolverse, solamente se puede explicar si un átomo tiene un núcleo pequeño, pesado y positivo. Rutherford supuso que solamente las fuerzas de atracción y repulsión eléctricas, tal como lo indica la ley de Coulomb, eran las responsables de cualquier desviación.
Cuando algunas de las partículas alfa se acercan directamente hacia dicho núcleo y puesto que la fuerza eléctrica varía con el cuadrado inverso de la distancia, aquellas sienten una repulsión que les causa la dispersión de gran ángulo o la desviación hacia atrás.
Para asegurarse, Geiger y Marsden experimentaron bombardeando láminas de distintos metales, no solamente oro, aunque este metal era el más apropiado por su maleabilidad, para crear láminas finísimas.
Al obtener resultados similares, Rutherford se convenció de que la carga positiva en el átomo debía encontrarse localizada en el núcleo, y no dispersa en todo su volumen, como postulaba Thomson en su modelo.
Por otro lado, como la gran mayoría de las partículas alfa pasaba sin desviarse, el núcleo debía ser muy, pero muy pequeño en comparación al tamaño atómico. No obstante, dicho núcleo debía concentrar la mayor parte de la masa del átomo.
Los resultados sorprendieron muchísimo a Rutherford, quien declaró en una conferencia en Cambridge: “…es como cuando disparas una bala de cañón de 15 pulgadas contra una hoja de papel de seda y el proyectil rebota directamente hacia ti y te golpea”.
Como estos resultados no podían ser explicados por el modelo atómico de Thomson, Rutherford propuso que el átomo estaba constituido por un núcleo, muy pequeño, muy masivo y cargado positivamente. Los electrones permanecían describiendo órbitas a su alrededor, cual sistema solar en miniatura.
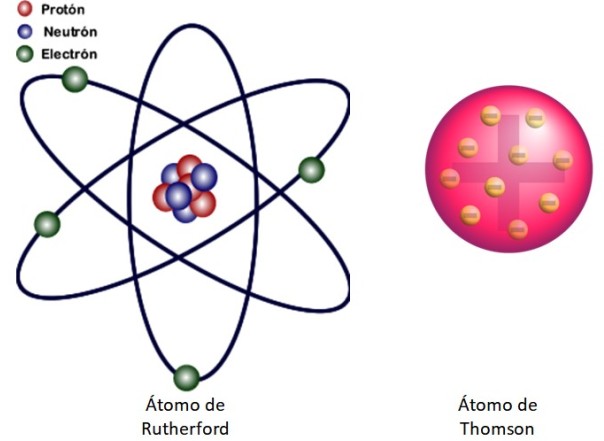
De esto se trata el modelo nuclear del átomo mostrado en la figura 3 a la izquierda. Como los electrones son muy, muy pequeños también, resulta ser que el átomo está casi todo…. ¡vacío! Por eso, la mayoría de las partículas alfa atraviesa la lámina sin desviarse apenas.
Y la analogía con un sistema solar en miniatura es muy acertada. El núcleo atómico desempeña el papel del Sol, conteniendo casi toda la masa más la carga positiva. Los electrones orbitan a su alrededor como los planetas y llevan la carga negativa. El conjunto es eléctricamente neutro.
Acerca de la distribución de los electrones en el átomo, el experimento de Rutherford no mostraba nada. Podría pensarse que las partículas alfa tendrían alguna interacción con ellos, pero la masa de los electrones es demasiado pequeña y no fueron capaces de desviar significativamente a las partículas.
Un problema con este modelo atómico era precisamente el comportamiento de los electrones.
Si estos no estaban estáticos, sino orbitando al núcleo atómico en órbitas circulares o elípticas, dirigidas por la atracción eléctrica, terminarían por precipitarse hacia el núcleo.
Ello se debe a que los electrones acelerados van perdiendo energía, y si eso pasa, sería el colapso del átomo y de la materia.
Afortunadamente esto no es lo que ocurre. Existe una suerte de estabilidad dinámica que evita el colapso. El siguiente modelo atómico, después del de Rutherford, fue el de Bohr, que dio algunas respuestas al porqué el colapso atómico no se produce.
Rutherford continuó haciendo experimentos de dispersión. Entre 1917 y 1918, él y su ayudante William Kay escogieron bombardear átomos de nitrógeno gaseoso con las partículas alfa muy energéticas, provenientes del bismuto-214.
Se sorprendió de nuevo, al detectar núcleos de hidrógeno. Esta es la ecuación de la reacción, la primera transmutación nuclear artificial jamás lograda:
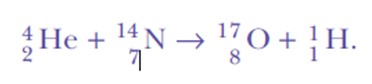
La respuesta era: del mismo nitrógeno. Rutherford había asignado al hidrógeno el número atómico 1, por ser el elemento más sencillo de todos: un núcleo positivo y un electrón negativo.
Rutherford había encontrado una partícula fundamental a la que denominó protón, un nombre derivado de la palabra griega para primero. De esta forma, el protón es un constituyente esencial de todo núcleo atómico.
Más adelante, hacia 1920, Rutherford propuso que debía existir una partícula neutra y con una masa muy semejante a la del protón. A esta partícula él la llamó neutrón y forma parte de casi todos los átomos conocidos. El físico James Chadwick la identificó finalmente en 1932.
El átomo de hidrógeno es, como hemos dicho, el más sencillo de todos. Sin embargo, no fue sencillo elaborar un modelo para este átomo.
Sucesivos descubrimientos dieron lugar a la Física Cuántica y a toda una teoría que describe los fenómenos a escala atómica. Durante este proceso, el modelo atómico también fue evolucionando. Pero veamos un poco la cuestión de los tamaños:
El átomo de hidrógeno tiene un núcleo compuesto por un protón (positivo) y posee un único electrón (negativo).
El radio del átomo de hidrógeno se ha estimado en 2.1 x 10-10 m, mientras que el del protón es de 0.85 x 10 -15 m o 0.85 femtómetros. El nombre de esta pequeña unidad se debe a Enrico Fermi y se usa mucho cuando se trabaja a esta escala.
Pues bien, el cociente entre el radio del átomo y el del núcleo es del orden de 105 m, es decir, ¡el átomo es 100000 veces más grande que el núcleo!.
Sin embargo, hay que tener en cuenta que en el modelo contemporáneo, basado en la Mecánica Cuántica, el electrón envuelve al núcleo en una suerte de nube llamada orbital (un orbital no es una órbita) y el electrón, a escala atómica, no es puntual.
Si el átomo de hidrógeno se ampliase -imaginariamente- hasta el tamaño de un campo de fútbol, entonces el núcleo compuesto de un protón positivo sería del tamaño de una hormiga en el centro del campo, mientras el electrón negativo sería como una especie de fantasma, esparcido por todo el campo y rodeando al núcleo positivo.
Este modelo atómico “tipo planetario” está muy arraigado y es la imagen que la mayoría de las personas tienen del átomo, ya que es muy fácil de visualizar. Sin embargo, no es el modelo aceptado hoy en día en el ámbito científico.
Los modelos atómicos contemporáneos están basados en la Mecánica Cuántica. Ella señala que el electrón en el átomo no es un puntito con carga negativa que sigue órbitas precisas, como las que imaginaba Rutherford.
Al contrario, el electrón está esparcido en zonas, alrededor del núcleo positivo, llamadas orbitales atómicos. De él podemos conocer la probabilidad de encontrarse en un estado o en otro.
Pese a ello, el modelo de Rutherford significó un enorme avance en el conocimiento de la estructura interior del átomo. Y allanó el camino para que más investigadores continúen perfeccionandolo.
- Andriessen, M. 2001. HSC Course. Physics 2. Jacaranda HSC Science.
- Arfken, G. 1984. University Physics. Academic Press.
- Knight, R. 2017. Physics for Scientists and Engineering: a Strategy Approach. Pearson.
- Physics OpenLab. The Rutherford-Geiger-Marsden Experiment. Recobrado de: physicsopenlab.org.
- Rex, A. 2011. Fundamentos de Física. Pearson.
- Tyson, T. 2013. The Rutherford Scattering Experiment. Recobrado de: 122.physics.ucdavis.edu.
- Xaktly. Rutherford’s Experiments. Recuperado de: xaktly.com.
- Wikipedia. Experimento de Rutherford. Recobrado de: es.wikipedia.org.
