Acetanilida (C8H9NO): qué es, estructura, propiedades, síntesis, usos
¿Qué es la acetanilida?
La acetanilida (C8H9NO) es una amida aromática que recibe varios nombres adicionales: N-acetilarilamina, N-fenilacetamida y acetanilo. Se presenta como un sólido inodoro en forma de hojuelas, su naturaleza química es de amida, y como tal puede formar gases inflamables al reaccionar con agentes reductores fuertes.
Además, es una base débil, pudiendo reaccionar con agentes deshidratantes como P2O5 para originar un nitrilo. Se encontró que la acetanilida tenía una acción analgésica y antipirética, y fue usada en el año 1886 con el nombre de Antifebrina por A. Cahn y P. Hepp.
En el año 1899 se introdujo en el mercado el ácido acetilsalicílico (la aspirina), que tenía las mismas acciones terapéuticas que la acetanilida. Al relacionarse el uso de la acetanilida con la aparición de cianosis en los pacientes —consecuencia de la metahemoglobinemia inducida por la acetanilida— se desechó su uso.
Posteriormente se estableció que la acción analgésica y antipirética de la acetanilida residía en un metabolito de esta denominado paracetamol (acetoaminofen), que no tenía sus efectos tóxicos, tal como sugirieron Axelrod y Brodie.
Estructura química
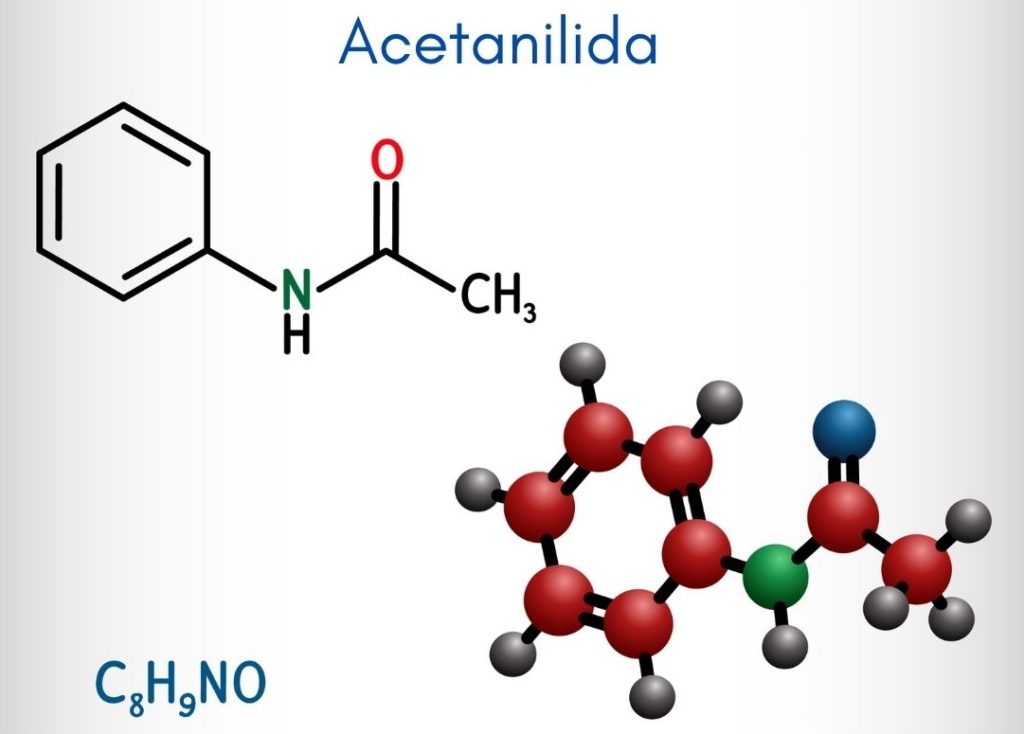
En la imagen superior se representa la estructura química de la acetanilida. A la derecha se encuentra el anillo aromático hexagonal del benceno (con líneas punteadas), y la izquierda está la razón por la que el compuesto consiste en una amida aromática: el grupo acetamido (HNCOCH3).
El grupo acetamido le confiere al anillo bencénico un mayor carácter polar; es decir, crea un momento dipolar en la molécula de la acetanilida.
¿Por qué? Porque el nitrógeno es más electronegativo que cualquiera de los átomos de carbono del anillo y, asimismo, está enlazado al grupo acilo, cuyo átomo de O también atrae densidad electrónica.
Por otra parte, casi toda la estructura molecular de la acetanilida descansa sobre un mismo plano debido a la hibridación sp2 de los átomos que la componen.
Existe una excepción vinculada a los del grupo –CH3, cuyos átomos de hidrógeno conforman los vértices de un tetraedro (las esferas blancas del extremo izquierdo salen del plano).
Estructuras de resonancia e interacciones intermoleculares
El par solitario sin compartir en el átomo de N circula por el sistema π del anillo aromático, originando varias estructuras de resonancia. No obstante, una de estas estructuras termina con la carga negativa en el átomo de O (más electronegativo) y una carga positiva en el átomo de N.
Así, existen estructuras de resonancia donde una carga negativa se desplaza en el anillo, y otra donde esta reside en el átomo de O. Como consecuencia de esta “asimetría electrónica” —la cual viene de la mano de la asimetría molecular—, la acetanilida interactúa intermolecularmente por fuerzas de tipo dipolo-dipolo.
Sin embargo, las interacciones por puentes de hidrógeno (N-H—O-…) entre dos moléculas de acetanilida son, de hecho, la fuerza predominante en su estructura cristalina.
De este modo, los cristales de acetanilida consisten en celdas unitarias ortorrómbicas de ocho moléculas orientadas con formas de “cintas planas” por sus puentes de hidrógeno.
Lo anterior puede visualizarse si se coloca una molécula de acetanilida encima de la otra, paralelamente. Entonces, como los grupos HNCOCH3 se sobreponen espacialmente, estos forman puentes de hidrógeno.
Además, entre estas dos moléculas también puede “colearse” una tercera, pero con su anillo aromático apuntando hacia el lado opuesto.
Propiedades químicas de la acetanilida
Peso molecular
135,166 g/mol.
Descripción química
Sólido blanco o grisáceo. Forma hojuelas blancas brillantes o un polvo blanco cristalino.
Olor
Inodoro.
Sabor
Ligeramente picante.
Punto de ebullición
304 ºC a 760 mmHg (579 ºF a 760 mmHg).
Punto de fusión
114,3 ºC (237,7 ºF).
Punto de destello o inflamabilidad
169 ºC (337 ºF). Medición hecha en vaso abierto.
Densidad
1,219 mg/mL a 15 ºC (1,219 mg/mL a 59 ºF)
Densidad de vapor
4,65 con relación al aire.
Presión de vapor
1 mmHg a 237 ºF, 1,22×10-3 mmHg a 25 ºC, 2Pa a 20 ºC.
Estabilidad
Sufre un rearreglo químico cuando es expuesto a la luz ultravioleta. ¿Cómo cambia la estructura? El grupo acetil forma nuevos enlaces en el anillo en las posiciones orto y para. Además, es estable en el aire e incompatible con agentes oxidantes fuertes, cáusticos y álcalis.
Volatilidad
Apreciablemente volátil a 95 ºC.
Autoignición
1004 ºF.
Descomposición
Se descompone al ser calentada, emitiendo un humo altamente tóxico.
pH
5 – 7 (10 g/L de H2O a 25 ºC)
Solubilidad
- En agua: 6,93×103 mg/mL a 25 ºC.
- Solubilidad de 1 g de acetanilida en diferentes líquidos: en 3,4 ml de alcohol, 20 ml de agua hirviente, 3 ml de metanol, 4 ml de acetona, 0,6 ml de alcohol hirviente, 3,7 ml de cloroformo, 5 ml de gliecerol, 8 ml de dioxano, 47 ml de benceno y 18 de éter. El hidrato de cloral aumenta la solubilidad de la acetanilida en agua.
Síntesis
Se sintetiza haciendo reaccionar el anhídrido acético con la acetanilida. Esta reacción aparece en muchos textos de Química Orgánica (Vogel, 1959):
C6H5NH2 + (CH3CO)2O => C6H5NHCOCH3 + CH3COOH
Aplicaciones
- Es un agente inhibidor del proceso de descomposición del peróxido de hidrógeno (agua oxigenada).
- Estabiliza a los barnices de éster de celulosa.
- Interviene como intermediario en la aceleración de la producción del caucho. Igualmente, es intermediario en la síntesis de algunos colorantes y del alcanfor.
- Actúa como un precursor en la síntesis de la penicilina.
- Es utilizada en la producción de cloruro de 4-acetamidosulfonilbenceno. La acetanilida reacciona con el ácido clorosulfónico (HSO3Cl), produciendo así el cloruro de 4-aminosulfonilbenceno. Este reacciona con el amonio o una amina orgánica primaria para formar las sulfonamidas.
- Se utilizó experimentalmente en el siglo XIX en el desarrollo de la fotografía.
- La acetanilida es usada como un marcador de los flujos electroosmóticos (EOF) en las electroforesis en capilares para el estudio del enlace entre drogas y proteínas.
- Recientemente se ha unido la acetanilida al 1-(ω-fenoxialkiluracilo) en experimentos de inhibición de la replicación del virus de la hepatitis C. La acetanilida se une a la posición 3 del anillo de la pirimidina.
- Los resultados experimentales señalan una reducción en la replicación del genoma viral, independientemente del genotipo viral.
- Antes de identificarse la toxicidad de la acetanilida, se la utilizó como analgésico y antipirético a partir de 1886. Posteriormente (1891), se usó en el tratamiento de la bronquitis crónica y aguda por Grün.
