Heptano (C7H16): estructura, propiedades y usos
El heptano es un compuesto orgánico cuya fórmula química es C7H16 y comprende nueve isómeros estructurales, de los cuales el más conocido es el lineal. Se trata de un hidrocarburo, específicamente un alcano o parafina, que se encuentra en la mayoría de los laboratorios de química orgánica, sean de docencia o investigativos.
A diferencia de otros solventes parafínicos, el heptano presenta una menor volatilidad, lo cual hace su uso relativamente más seguro; siempre que no haya una fuente de calor rodeando sus vapores y se le trabaje dentro de una campana extractora. Dejando a un lado su inflamabilidad, es un compuesto lo suficiente inerte para servir como medio de reacciones orgánicas.
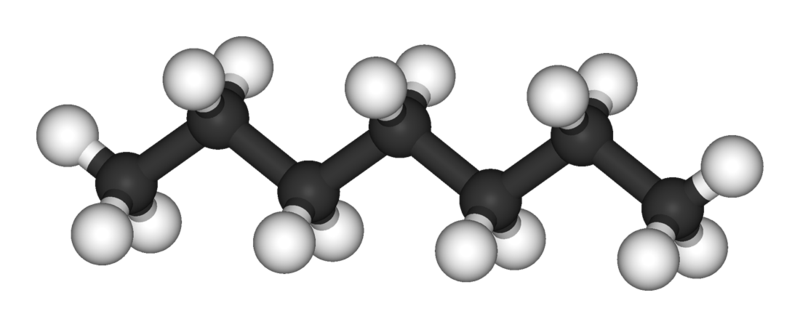
En la imagen superior se tiene la estructura del n-heptano, el isómero lineal de todos los heptanos. Debido a que es el isómero más común y de mayor valor comercial, así como el más fácil de sintetizar, se tiende a sobreentender que el término ‘heptano’ se refiere exclusivamente al n-heptano; a menos que se indique lo contrario.
No obstante, en las botellas de este compuesto líquido sí se especifica que contiene n-heptano. Tienen que destaparse dentro de una campana extractora y realizarse las mediciones cuidadosamente.
Es un excelente disolvente para las grasas y aceites, por lo que se utiliza con frecuencia durante las extracciones de esencias vegetales u otros productos naturales.
Índice del artículo
- 1 Estructura
- 2 Propiedades del heptano
- 2.1 Aspecto físico
- 2.2 Masa molar
- 2.3 Punto de fusión
- 2.4 Punto de ebullición
- 2.5 Presión de vapor
- 2.6 Densidad
- 2.7 Solubilidad en agua
- 2.8 Solubilidad en otros solventes
- 2.9 Índice de refracción (nD)
- 2.10 Viscosidad
- 2.11 Capacidad calorífica
- 2.12 Punto de ignición
- 2.13 Temperatura de autoignición
- 2.14 Tensión superficial
- 2.15 Calor de combustión
- 2.16 Reactividad
- 3 Usos
- 4 Referencias
Tal como se aprecia en la primera imagen, la molécula de n-heptano es lineal, y debido a la hibridación química de sus átomos de carbono, la cadena adopta una forma zigzagueada. Esta molécula es dinámica, pues sus enlaces C-C pueden rotar, lo cual hace que la cadena se pliegue levemente en distintos ángulos. Esto contribuye a sus interacciones intermoleculares.
El n-heptano es una molécula apolar, hidrofóbica, y por consiguiente sus interacciones se basan en las fuerzas dispersivas de London; estas son, aquellas que dependen de la masa molecular del compuesto y de su área de contacto. Dos moléculas de n-heptano se aproximan entre sí de tal modo que “calcen” sus cadenas una encima de otra.
Estas interacciones son lo suficiente efectivas para mantener las moléculas de n-heptano cohesionadas en un líquido que hierve a 98 ºC.

Al principio se dijo que la fórmula C7H16 representaba un total de nueve isómeros estructurales, siendo el n-heptano el más relevante (1). Los otros ocho isómeros se muestran en la imagen superior. Nótese a simple vista que unos son más ramificados que otros. De izquierda a derecha, empezando desde arriba, tenemos:
(2): 2-metilhexano
(3): 3-metilhexano, el cual consiste de un par de enantiómeros (a y b)
(4): 2,2-dimetilpentano, conocido también como neoheptano
(5): 2,3-dimetilpentano, otra vez con un par de enantiómeros
(6): 2,4-dimetilpentano
(7): 3,3-dimetilpentano
(8): 3-etilpentano
(9): 2,2,3-trimetilbutano.
Cada uno de estos isómeros tienen propiedades y aplicaciones independientes del n-heptano, reservados más que todo para los ámbitos de síntesis orgánicas.
Líquido incoloro con un olor parecido al de la gasolina.
100,205 g/mol
-90,549 ºC, convirtiéndose en un cristal molecular.
98,38 ºC.
52,60 atm a 20 ºC. Nótese lo alta que es su presión vapor, a pesar de ser menos volátil que otros solventes parafínicos, como el hexano y pentano.
0,6795 g/cm3. Por otro lado, los vapores de heptano son 3,45 veces más densos que el aire, lo que significa que sus vapores perdurarán en los espacios donde se derrame un poco de su líquido.
El heptano por ser un compuesto hidrofóbico apenas puede disolverse en el agua para originar una solución con una concentración de 0,0003% a una temperatura de 20 ºC.
El heptano es miscible con el tetracloruro de carbono, el etanol, la acetona, el éter de petróleo y cloroformo.
1,3855.
0,389 mPa·s
224,64 J/K·mol
-4 ºC
223 ºC
19,66 mN/m a 25 ºC
4817 kJ/mol.
Los vapores de heptano cuando están cerca de una fuente de calor (una llama), reaccionan exotérmica y vigorosamente con el oxígeno del aire:
C7H16 + 11O2 => 7CO2 + 8H2O
No obstante, fuera de la reacción de combustión, el heptano es un líquido bastante estable. Su falta de reactividad se debe a que sus enlaces C-H son difíciles de romper, por lo que no es susceptible a sufrir sustituciones. Asimismo, es poco sensible a los agentes oxidantes fuertes, siempre que no haya fuego en la cercanía.
El mayor peligro del heptano lo representa su alta volatilidad e inflamabilidad, por lo que se corre un riesgo de incendio si este se derrama en sitios calientes.

El carácter hidrofóbico del heptano lo hace un solvente excelente para disolver aceites y grasas. En este aspecto se ha utilizado como desengrasante. Sin embargo, su mayor aplicación radica en ser usado como solvente extractor, ya que disuelve los componentes lipídicos, así como los demás compuestos orgánicos de una muestra.
Por ejemplo, si se quisiera extraer todos los componentes del café molido, este se maceraría en heptano en lugar de agua. Este método y sus variaciones se han implementado con todo tipo de semillas, gracias a los cuales se han obtenido esencias vegetales y otros productos naturales.
El heptano, que naturalmente es incoloro, se teñirá del color del aceite extraído. Luego, este se rotaevapora para tener finalmente un volumen del aceite lo más puro posible.
Por otro lado, la poca reactividad del heptano también le permite ser una opción al momento de considerar un medio de reacción para llevar a cabo una síntesis. Al ser un buen disolvente de compuestos orgánicos, garantiza que los reactivos permanezcan en solución e interaccionen entre sí apropiadamente mientras reaccionan.
En la química del petróleo es una práctica común precipitar los asfaltenos de una muestra de crudo mediante la adición de heptano. Este método permite estudiar la estabilidad de distintos crudos y determinar qué tan susceptible es su contenido de asfaltenos de precipitar y acarrear toda una serie de problemas para la industria petrolera.
El heptano se ha usado como combustible debido a la gran cantidad de calor que desprende cuando arde. No obstante, en lo que respecta a los motores de automóviles, resultaría perjudicial para su funcionamiento si se utilizara en forma pura. Debido a que arde muy explosivamente, sirve para definir el 0 en la escala del octanaje de la gasolina.
La gasolina contiene un alto porcentaje de heptano y otros hidrocarburos para nivelar el octanaje hasta los valores conocidos (91, 95, 87, 89, etc.).
- Morrison, R. T. y Boyd, R, N. (1987). Química Orgánica. 5ta Edición. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Wikipedia. (2020). Heptane. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. (2020). Heptane PubChem Database. CID=8900. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Elsevier B.V. (2020). Heptanes. ScienceDirect. Recuperado de: sciencedirect.com
- Bell Chem Corp. (07 de septiembre de 2018). Industrial Uses of Heptane. Recuperado de: bellchem.com
- Andrea Kropp. (2020). Heptane: Structure, Uses & Formula. Study. Recuperado de: study.com
