Soluciones valoradas: tipos y ejemplos
Las solucionesvaloradas o soluciones estándar son aquellas en las que las medidas de concentración de sus componentes son conocidas y seguidas con precisión. Las medidas de concentración están estandarizadas.
Todas las sustancias son mezclas homogéneas compuestas por dos elementos básicos: un soluto y un solvente. El soluto es la parte que se disuelve y el solvente es la parte que disuelve el soluto.
Cabe destacar que el soluto se encuentra en menor cantidad que el solvente. En este sentido, en las sustancias valoradas, se conocen las cantidades exactas de soluto y de solvente que se requieren para hacer la solución estándar.
Para realizar una solución valorada se deben pesar o medir cada uno de los componentes de la solución y asegurarse de que ni un miligramo de soluto o de solvente quede adherido en alguno de los instrumentos de medición.
Soluciones empíricas y soluciones valoradas
Las soluciones pueden ser de dos tipos: empíricas o valoradas. Las primeras son aquellas en las que las cantidades de soluto y solvente que se mezclan son desconocidas. En las soluciones empíricas, no importan las medidas.
Por el contrario, las soluciones valoradas son aquellas en las que las cantidades de soluto y solvente que se mezclan son conocidas por el que hace la solución.
En este tipo de soluciones, las medidas de los componentes son esenciales para garantizar el funcionamiento de la sustancia.
Componentes de una solución valorada
En términos generales, los componentes de una solución valorada son los mismos que los de cualquier otra solución. Es decir, un soluto y un solvente.
El soluto es la parte de la solución que se disuelve. Se presenta en menor cantidad. Por su parte, el solvente es la parte de la solución que disuelve y se encuentra en mayor cantidad.
Concentración
Se conoce como concentración a la medida que expresa la relación entre las cantidades de los elementos de una solución (soluto y solvente). Dicha relación es la que se presenta a continuación:
Concentración = cantidad de soluto / cantidad de solvente.
– Formas de presentar la concentración
Molaridad
Generalmente, las concentraciones de las soluciones valoradas se expresan en unidades de moles por litros (mol / L), moles por decímetro cúbico (mol / dm 3), kilomoles por metro cúbico (kmol / m 3), entre otros. Esta medida de concentración es conocida como molaridad.
La fórmula para la molaridad es la siguiente:
Molaridad = número de moles de soluto (mol) / litros de solución (L).
La unidad de expresión mol / L puede ser resumida en la unidad M.
Porcentaje en masa (% en masa)
Otra de las formas comunes es la del porcentaje en masa (% en masa). Esta expresión de concentración relaciona la masa del soluto con cien unidades de masa de la solución.
La masa suele ser expresada en gramos, sin embargo, se pueden utilizar otras medidas de masa.
La fórmula para el porcentaje en masa es la siguiente:
% en masa = ( masa de soluto / masa de la disolución ) x 100
Porcentaje en volumen (% en volumen)
El porcentaje en volumen expresa la relación entre la cantidad de soluto en volumen y cien unidades de volumen de la solución. Las medidas más empleadas son el litro (L) y el centímetro cúbico (cm 3).
La fórmula para el porcentaje en volumen es la siguiente:
% en volumen = ( volumen de soluto / volumen de solución ) x 100
Gramos por litro (g / L)
Esta expresión de concentración establece una relación entre la masa de soluto (expresada en gramos) y el volumen de la solución (expresada en litros).
Se utiliza en prácticas a nivel educativo, sin embargo, no es común en el ámbito profesional.
La fórmula para esta expresión es la siguiente:
g / L = gramos de soluto / litros de solución
Tipos de soluciones valoradas
Existen tres tipos de soluciones valoradas: las iónicas, las elementales y las formuladas.
Soluciones valoradas iónicas
Son aquellas en las que los componentes de la solución (el soluto y el solvente) forman enlaces iónicos. Esto quiere decir que se presentan dos o más iones enlazados.
De estos iones, uno tiene carga positiva (se denomina catión) y el otro tiene carga negativa (se denomina anión).
Este tipo de soluciones se emplea para el análisis de aniones como el cloruro (Cl -) y el sulfato (SO4 2-). Asimismo, se emplea en el análisis de cationes como el sodio (Na +) y el potasio (K +).
Soluciones valoradas elementales
Estas soluciones están formadas por elementos en estado puro y se obtienen a partir de disoluciones de otros compuestos.
Soluciones valoradas formuladas
Estas soluciones se basan en el cálculo del peso atómico y el número de elementos presentes en la solución.
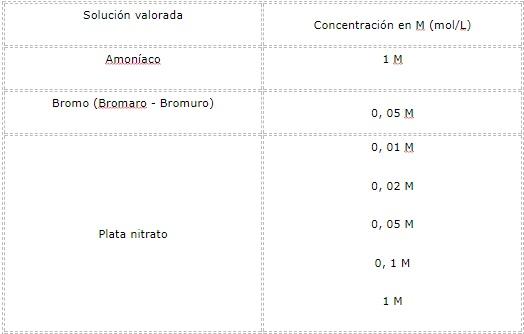
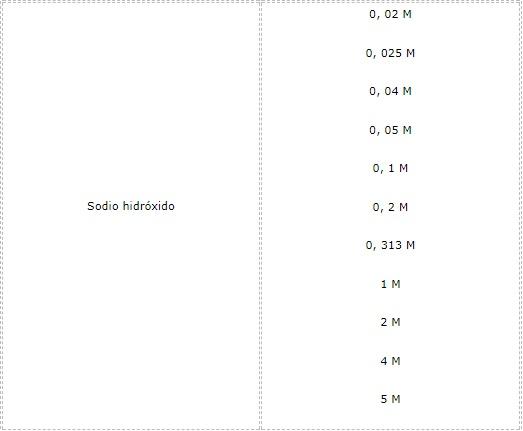
Ejemplos de soluciones valoradas
Muchos laboratorios producen soluciones valoradas. Las fórmulas para estas sustancias es conocida ampliamente, por lo que cualquier laboratorio competente en el área puede reproducir los resultados.
A continuación, se presentan algunas de estas:

Referencias
- Standard solutions. Recuperado el 2 de agosto de 2017, de en.wikipedia.org
- Standard solutions. Recuperado el 2 de agosto de 2017, de study.com
- Standard solution definition. Recuperado el 2 de agosto de 2017, de thoughtco.com
- Guide to Preparationof Standard Solutions. Recuperado el 2 de agosto de 2017, de chemiasoft.com
- IUPAC Gold Book – Standard Solution. Recuperado el 2 de agosto de 2017, de goldbook.iupac.org
- Stock Standard Solutions. Recuperado el 2 de agosto de 2017, de chemiasoft.com
- Making Standard Solutions. Recuperado el 2 de agosto de 2017, de creative-chemestry.org.
