Queratina: tipos, estructura, localización y funciones
La queratina es una proteína fibrosa insoluble que forma parte estructural de las células y de los integumentos de muchos organismos, especialmente de los animales vertebrados. Tiene formas muy variadas y es poco reactiva, químicamente hablando.
Su estructura fue descrita por primera vez por los científicos Linus Pauling y Robert Corey en el año 1951, mientras analizaban la estructura del pelo animal. Estos investigadores también dieron indicios sobre la estructura de la miosina del tejido muscular
Después del colágeno, es una de las proteínas más importantes de los animales y representa la mayor parte del peso seco del pelo, de la lana, de las uñas, garras y pezuñas, de las plumas, de los cuernos y de parte sustancial de la capa externa de la piel.
Los elementos o las partes “queratinizadas” de los animales pueden tener morfologías muy diferentes que dependen, en gran medida, de la función que ejercen en cada organismo en particular.
La queratina es una proteína que posee características que le otorgan gran eficiencia mecánica en cuanto a tensión y a compresión. Es producida por un tipo especial de células que se denominan “queratinocitos”, que usualmente mueren después de que la producen.
Algunos autores afirman que las queratinas se expresan de forma tejido y estadio-específica. En los humanos hay más de 30 genes codificantes para estas proteínas y estos pertenecen a una familia que evolucionó por varias rondas de duplicación genética.
Índice del artículo
Existen, esencialmente, dos tipos de queratinas: las α y las β. Estas se distinguen por poseer una estructura básica que está compuesta primordialmente por cadenas polipeptídicas que pueden enrollarse como hélices alfa (α-queratinas) o unirse paralelamente como las láminas β-plegadas (β-queratinas).
Este tipo de queratina es el más estudiado y se sabe que los mamíferos tienen al menos 30 variantes distintas de este tipo de queratinas. En estos animales, las α-queratinas forman parte de uñas, pelo, cuernos, cascos, púas y epidermis.
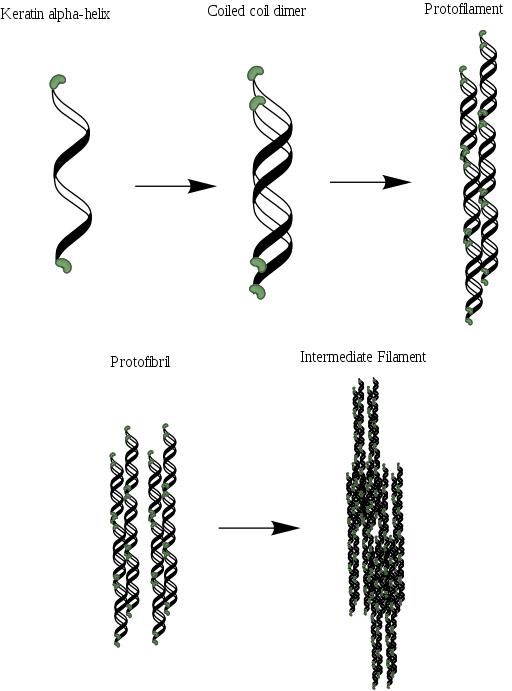
Al igual que el colágeno, estas proteínas contienen en su estructura una abundante proporción de aminoácidos pequeños como la glicina y la alanina, que son los que hacen posible el establecimiento de las hélices alfa. La estructura molecular de una α-queratina se compone de tres regiones diferentes: (1) las fibrillas cristalinas o las hélices, (2) los dominios terminales de los filamentos y (3) la matriz.
Las hélices son dos y forman un dímero que se asemeja a una espiral enroscada que se mantiene unida gracias a la presencia de enlaces o puentes disulfuro (S-S). Cada una de las hélices tiene aproximadamente 3.6 residuos aminoacídicos en cada giro que da y se compone de más o menos 310 aminoácidos.
Estas espirales enroscadas se pueden asociar luego para formar una estructura conocida como protofilamento o protofibrilla, que tiene la capacidad de ensamblarse con otros de su mismo tipo.
Los protofilamentos poseen extremos N- y C-terminales no helicoidales que son ricos en residuos de cisteína y que están unidos a la región central o matriz. Estas moléculas se polimerizan para formar los filamentos intermedios que tienen un diámetro cercano a los 7nm.
Se distinguen dos tipos de filamentos intermedios compuestos por queratina: los filamentos intermedios acídicos (tipo I) y los básicos (tipo II). Estos están embebidos en una matriz proteica y la forma en la que se ordenan estos filamentos influye directamente en las propiedades mecánicas de la estructura que conforman.
En los filamentos de tipo I, las hélices se conectan entre sí por medio de tres “conectores helicoidales” conocidos como L1, L12 y L2 y que se piensa proveen flexibilidad al dominio helicoidal. En los filamentos de tipo II existen, además, dos subdominios que se encuentran entre los dominios helicoidales.
Ejemplo de una estructura con α-queratinas: el pelo
Si se analiza la estructura de un pelo típico, este tiene un diámetro aproximado de 20 micras y está compuesto de células muertas que contienen macrofibrillas empaquetadas que se orientan de forma paralela (una al lado de la otra).

Las macrofibrillas se componen de microfibrillas, que tienen menor diámetro y están unidas unas con otras a través de una sustancia proteica amorfa con altos contenidos de azufre.
Estas microfibrillas son grupos de protofibrillas más pequeñas con un patrón de organización 9+2, que quiere decir que nueve protofibrillas rodean a dos protofibrillas centrales; todas estas estructuras están compuestas esencialmente por α-queratina.
Dependiendo del contenido de azufre que tengan, las α-queratinas pueden clasificarse como queratinas blandas o queratinas duras. Ello tiene que ver con la fuerza de resistencia mecánica que imponen los enlaces disulfuro en la estructura proteica.
En el grupo de las queratinas duras se incluyen las que forman parte del pelo, los cuernos y las uñas, mientras que las queratinas blandas están representadas por los filamentos que se encuentran en la piel y los callos.
Los enlaces disulfuro pueden eliminarse mediante la aplicación de algún agente reductor, por lo que las estructuras compuestas por queratina no son fácilmente digeribles por los animales, a menos de que estos posean intestinos ricos en mercaptanos, como es el caso de algunos insectos.
Las β-queratinas son mucho más fuertes que las α-queratinas y se encuentran en los reptiles y las aves como parte de las garras, las escamas, las plumas y los picos. En los geckos, las microvellosidades que se encuentran en sus patas (setas) también están compuestas por esta proteína.
Su estructura molecular está compuesta por láminas β-plegadas formadas por cadenas polipeptídicas antiparalelas que se unen entre sí a través de enlaces o puentes de hidrógeno. Estas cadenas, una al lado de la otra, forman unas pequeñas superficies rígidas y planas, ligeramente plegadas.
Las funciones de la queratina se relacionan, sobre todo, con el tipo de estructura que construye y el lugar del cuerpo del animal donde se encuentra.
Como otras proteínas fibrosas, esta confiere estabilidad y rigidez estructural a las células, ya que pertenece a la gran familia de proteínas conocida como la familia de los filamentos intermedios, que son proteínas del citoesqueleto.
La capa superior de la piel de los animales superiores posee una gran red de filamentos intermedios formados por queratina. Esta capa se denomina epidermis y tiene entre 30 micras y 1 nm de espesor en los humanos.
La epidermis funciona como barrera protectora contra diferentes tipos de estrés mecánico y químico y es sintetizada por un tipo especial de células llamado “queratinocitos”.
Además de la epidermis, existe una capa aún más externa que se muda constantemente y se conoce como estrato córneo, que cumple funciones similares.
Espinas y púas también son empleadas por diversos animales para su propia protección contra depredadores y otros agresores.
La “armadura” de los Pangolines, unos pequeños mamíferos insectívoros que habitan en Asia y África, también está compuesta por “escamas” de queratina que los protegen.
Los cuernos se observan en animales de la familia Bovidae, es decir, en vacas, ovejas y cabras. Son estructuras muy fuertes y resistentes y los animales que los tienen los emplean como órganos de defensa y cortejo.
Los cuernos están formados por un centro óseo compuesto por hueso “esponjoso” que está recubierto por piel que se proyecta desde la zona posterior del cráneo.

Las garras y las uñas, además de sus funciones en la alimentación y la sujeción, también les sirven a los animales como “armas” de defensa contra atacantes y depredadores.
Los picos de las aves cumplen varios propósitos entre los que destacan la alimentación, la defensa, el cortejo, el intercambio de calor, y el aseo, entre otros. Se encuentran en la naturaleza múltiples variedades de picos en las aves, especialmente en cuanto a forma, color, tamaño y fuerza de las mandíbulas asociadas.
Los picos están compuestos, al igual que los cuernos, por un centro óseo que se proyecta desde el cráneo y que está cubierto con láminas resistentes de β-queratina.
Los dientes de los animales no mandibulados (vertebrados “ancestrales”) están compuestos por queratina y, al igual que los dientes de los vertebrados “superiores”, tienen múltiples funciones en la alimentación y la defensa.
Los cascos de muchos animales rumiantes y ungulados (caballos, asnos, alces, etc.) están compuestos por queratina, son muy resistentes y están diseñados para proteger las patas y colaborar en el movimiento.
Las plumas, que también son empleadas por los pájaros para desplazarse, están compuestas por β-queratina. Estas estructuras, además, tienen funciones en el camuflaje, en el cortejo, en el aislamiento térmico y en la impermeabilidad.

La industria textil es una de las principales explotadoras de las estructuras queratinizadas, antropocéntricamente hablando. La lana y el pelo de muchos animales tiene importancia a nivel industrial, pues con ellos se manufacturan diversas prendas que le son útiles a los hombres desde diversos puntos de vista.
- Koolman, J., & Roehm, K. (2005). Color Atlas of Biochemistry (2nd ed.). New York, USA: Thieme.
- Mathews, C., van Holde, K., & Ahern, K. (2000). Biochemistry (3th ed.). San Francisco, California: Pearson.
- Nelson, D. L., & Cox, M. M. (2009). Lehninger Principios de Bioquímica. Ediciones Omega (5th ed.).
- Pauling, L., & Corey, R. (1951). The Structure of Hair, Muscle, and Related Proteins. Chemistry, 37, 261–271.
- Phillips, D., Korge, B., & James, W. (1994). Keratin and keratinization. Journal of the American Academy of Dermatology, 30(1), 85–102.
- Rouse, J. G., & Dyke, M. E. Van. (2010). A Review of Keratin-Based Biomaterials for Biomedical Applications. Materials, 3, 999–1014.
- Smith, F. J. D. (2003). The Molecular Genetics of Keratin Disorders. Am J Clin Dermatol, 4(5), 347–364.
- Voet, D., & Voet, J. (2006). Bioquímica (3th ed.). Editorial Médica Panamericana.
- Wang, B., Yang, W., McKittrick, J., & Meyers, M. A. (2016). Keratin: Structure, mechanical properties, occurrence in biological organisms, and efforts at bioinspiration. Progress in Materials Science.
