Quimotripsina: características, estructura, funciones, mecanismo de acción
La quimotripsina es la segunda proteína digestiva más abundante secretada por el páncreas hacia el intestino delgado. Es una enzima perteneciente a la familia de las serín-proteasas y se especializa en la hidrólisis de los enlaces peptídicos entre aminoácidos como la tirosina, la fenilalanina, el triptófano, la metionina y la leucina presentes en proteínas de gran tamaño.
El nombre “quimiotripsina” reúne, en realidad, a un grupo de enzimas que son producidas por el páncreas y que participan activamente de la digestión intestinal de proteínas en los animales. La palabra deriva de la acción tipo renina que tiene esta enzima sobre los contenidos gástricos o el “quimo”.
A pesar de que no se sabe con exactitud qué tan amplia es su distribución en el reino animal, se considera que estas enzimas están presentes al menos en todos los cordados y existen reportes de su presencia en “filos más primitivos” como el de los artrópodos y el de los celenterados.
En aquellos animales que poseen páncreas, tal órgano es el principal sitio de producción de quimotripsinas, así como de otras proteasas, inhibidores enzimáticos y precursores o zimógenos.
Las quimotripsinas son las enzimas más estudiadas y mejor caracterizadas, no solo en relación a su biosíntesis, sino también con su activación a partir del zimógeno, sus propiedades enzimáticas, su inhibición, sus características cinéticas y catalíticas y su estructura general.
Índice del artículo
Las quimotripsinas son endopeptidasas, es decir, son proteasas que hidrolizan enlaces peptídicos de aminoácidos en posiciones “internas” de otras proteínas; aunque también se ha demostrado que pueden hidrolizar ésteres, amidas y arilamidas, aunque con menor selectividad.
Tienen un peso molecular promedio de unos 25 kDa (245 aminoácidos) y son producidas a partir de precursores que se conocen como quimiotripsinógenos.
Del páncreas de animales bovinos se han purificado 2 tipos de quimiotripsinógenos, el A y el B. En el modelo porcino se describió un tercer quimiotripsinógeno, el quimotripsinógeno C. Cada uno de estos tres zimógenos es responsable de la producción de las quimotripsinas A, B y C, respectivamente.
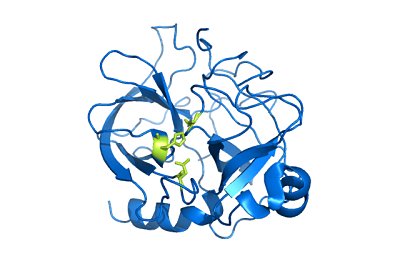
La quimotripsina A está formada por tres cadenas polipeptídicas que están unidas entre sí covalentemente a través de puentes o enlaces disulfuro entre residuos de cisteína. Sin embargo, es importante mencionar que muchos autores la consideran una enzima monomérica (compuesta por una sola subunidad).
Estas cadenas componen una estructura que tiene forma de elipsoide, en la cual los grupos que poseen cargas electromagnéticas se ubican hacia la superficie (a excepción de los aminoácidos que participan en las funciones catalíticas).
Generalmente las quimotripsinas son sumamente activas a pH ácidos, aunque aquellas que han sido descritas y purificadas de insectos y de otros animales no vertebrados son estables a pH entre 8 y 11 y sumamente inestables a pH más bajos.
Cuando el páncreas exocrino es estimulado, bien sea por hormonas o por impulsos eléctricos, este órgano libera unos gránulos secretorios ricos en quimiotripsinógeno, el cual, una vez alcanza el intestino delgado es cortado por otra proteasa entre los residuos 15 y 16 y después es “auto procesada” para rendir una proteína completamente activa.
Quizá la función principal de esta enzima es actuar en concierto con las demás proteasas excretadas hacia el sistema gastrointestinal para la digestión o degradación de las proteínas consumidas con los alimentos.
Los productos de dicha proteólisis sirven, posteriormente, como fuente de carbono y energía a través del catabolismo de aminoácidos o pueden ser “reciclados” directamente para la conformación de nuevas proteínas celulares que ejercerán múltiples y variadas funciones a nivel fisiológico.
Las quimotripsinas ejercen sus acciones solo después de ser activadas, pues estas son producidas como unas formas “precursoras” (zimógenos) denominadas quimiotripsinógenos.
Los zimógenos de la quimotripsina son sintetizados por las células acinares del páncreas, luego de lo cual migran desde el retículo endoplásmico hacia el complejo de Golgi, donde son empaquetadas dentro de complejos membranosos o gránulos secretorios.
Estos gránulos se acumulan en los extremos de los acinos y son liberados en respuesta a estímulos hormonales o impulsos nerviosos.
Dependiendo de las condiciones de activación se pueden encontrar varios tipos de quimotripsinas, sin embargo, todas implican el “corte” proteolítico de un enlace peptídico en el zimógeno, el quimotripsinógeno, proceso catalizado por la enzima tripsina.
La reacción de activación consiste inicialmente en el corte del enlace peptídico entre los aminoácidos 15 y 16 del quimotripsinógeno, con lo que se forma la π-quimotripsina, capaz de “auto procesarse” y completar la activación por autocatálisis.
La acción de esta última enzima promueve la formación de tras péptidos unidos mediante enlaces disulfuros y estos se conocen como la cadena A (de la región N-terminal y los residuos 1-14), la cadena B (residuos del 16 al 146) y la cadena C (región C-terminal, que comienza con el residuo 149).
Las porciones correspondientes a los residuos 14-15 y 147-148 (dos dipéptidos) no tienen funciones catalíticas y se desprenden de la estructura principal.
La quimotripsina se encarga de hidrolizar enlaces peptídicos, atacando predominantemente la porción carboxílica de los aminoácidos que poseen grupos laterales aromáticos, es decir, aminoácidos como la tirosina, el triptófano y la fenilalanina.
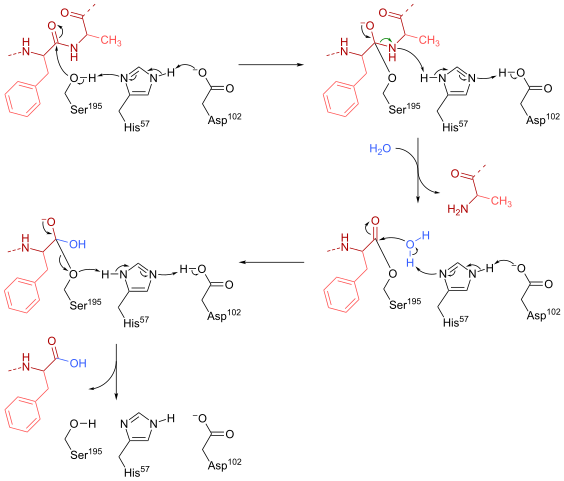
Una serina (Ser 195) dentro del sitio activo (Gly-Asp-Ser-Gly-Glu-Ala-Val) de este tipo de enzimas es quizá el residuo más esencial para su funcionamiento. El mecanismo de reacción es como sigue:
– La quimotripsina inicialmente se encuentra en una forma “libres de sustrato”, donde la “triada” catalítica consiste en el grupo carboxilo lateral de un residuo de aspartato (102), el anillo de imidazol de un residuo de histidina (57) y el grupo hidroxilo lateral de una serina (195).
– El sustrato se encuentra con la enzima y se une a esta para formar un complejo reversible enzima-sustrato típico (según el modelo de micaeliano), donde la “triada” catalítica facilita el ataque nucleofílico al activar el grupo hidroxilo del residuo de serina.
– El punto clave del mecanismo de reacción consiste en la formación de un enlace parcial, lo que resulta en la polarización del grupo hidroxilo, que es suficiente para acelerar la reacción.
– Luego del ataque nucleofílico, el grupo carboxilo se convierte en un intermediario oxianión tetraédrico, el cual es estabilizado por dos puentes de hidrógeno formados por los grupos N y H del residuo de Gly 193 y Ser 195.
– El oxianión se “reacomoda” espontáneamente y se forma un intermediario enzimático al cual se le ha añadido un grupo acilo (enzima acilada).
– La reacción continúa con la entrada de un molécula de agua al sitio activo, molécula que promueve un nuevo ataque nucleofílico que resulta en la formación de un segundo intermediario tetraédrico que también es estabilizado por unos puentes de hidrógeno.
– La reacción termina cuando este segundo intermediario se reacomoda nuevamente y forma otra vez el complejo micaeliano enzima-sustrato, donde el sitio activo de la enzima está ocupado por el producto que contiene el grupo carboxilo.
- Appel, W. (1986). Chymotrypsin: molecular and catalytic properties. Clinical biochemistry, 19(6), 317-322.
- Bender, M. L., Killheffer, J. V., & Cohen, S. (1973). Chymotrypsin. CRC critical reviews in biochemistry, 1(2), 149-199.
- Blow, D. M. (1971). 6 The Structure of Chymotrypsin. In The enzymes (Vol. 3, pp. 185-212). Academic Press.
- Blow, D. M. (1976). Structure and mechanism of chymotrypsin. Accounts of chemical research, 9(4), 145-152.
- Nelson, D. L., Lehninger, A. L., & Cox, M. M. (2008). Lehninger principles of biochemistry. Macmillan.
- Polgár, L. (2013). Catalytic mechanisms of serine and threonine peptidases. In Handbook of Proteolytic Enzymes (pp. 2524-2534). Elsevier Ltd.
- Westheimer, F. H. (1957). Hypothesis for the mechanism of action of chymotrypsin. Proceedings of the National Academy of Sciences of the United States of America, 43(11), 969.
