Masa molar: cómo se calcula, ejemplos y ejercicios resueltos
La masa molar es una propiedad intensiva de la materia que relaciona el concepto de mol con las mediciones de masa. Siendo más concisos, es la cantidad de masa correspondiente a un mol de sustancia; es decir, lo que “pesa” un número de Avogadro, (6.022·1023) de partículas determinadas.
Un mol de cualquier sustancia contendrá el mismo número de partículas (iones, moléculas, átomos, etc.); sin embargo, su masa variará debido a que sus dimensiones moleculares vienen definidas por el número de átomos y los isótopos que integran su estructura. Mientras más másico sea el átomo o la molécula, más grande será su masa molar.
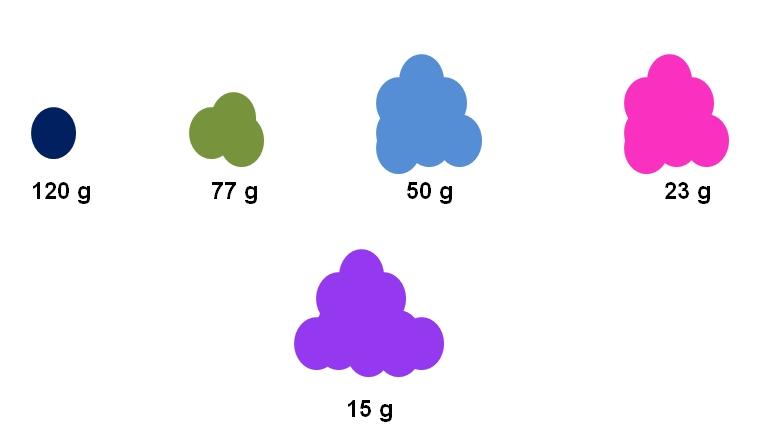
Por ejemplo, supongamos que se reúne exactamente un mol para cinco compuestos distintos (imagen superior). Utilizando una balanza, se ha medido la masa para cada cúmulo, expresada debajo. Esta masa corresponde a la masa molar. De todos ellos, el compuesto morado es el que tiene las partículas más livianas, mientras que el compuesto azul oscuro, las partículas más pesadas.
Nótese que se muestra una tendencia generalizada y exagerada: a mayor masa molar, menor es la cantidad de muestra que debe colocarse en la balanza. No obstante, este volumen de materia también depende enormemente del estado de agregación de cada compuesto y de su densidad.
Índice del artículo

La masa molar puede calcularse partiendo de su definición: cantidad de masa por mol de sustancia:
M = gramos de sustancia /mol de sustancia
De hecho, g/mol es la unidad en la que usualmente viene expresada la masa molar, junto a kg/mol. Así, si conocemos cuántos moles tenemos de un compuesto o elemento, y lo pesamos, llegaremos directamente a su masa molar aplicando una sencilla división.
La masa molar no solo aplica para los compuestos, sino también para los elementos. El concepto de moles no discrimina en lo absoluto. Por lo tanto, con la ayuda de una tabla periódica ubicamos las masas atómicas relativas para un elemento de interés, y multiplicamos su valor por 1 g/mol; esta es, la constante de Avogadro, MU.
Por ejemplo, la masa atómica relativa del estroncio es 87,62. Si queremos tener su masa atómica, sería 87,62 uma; pero si lo que buscamos es su masa molar, entonces será 87,62 g/mol (87,62·1g/mol). Y así, las masas molares de todos los demás elementos se obtienen del mismo modo, sin necesidad siquiera de realizar dicha multiplicación.
La masa molar de un compuesto no es más que la sumatoria de las masas atómicas relativas de sus átomos multiplicada por MU.
Por ejemplo, la molécula de agua, H2O, tiene tres átomos: dos de hidrógeno y uno de oxígeno. Las masas atómicas relativas del H y O son 1,008 y 15,999, respectivamente. Así, sumamos sus masas multiplicando por el número de átomo presentes en la molécula del compuesto:
2 H · (1,008) = 2,016
1 O · (15,999) = 15,999
M(H2O) = (2,016 + 15,999)·1g/mol = 18,015 g/mol
Es una práctica bastante común el omitir MU al final:
M(H2O) = (2,016 + 15,999) = 18,015 g/mol
Se sobreentiende que la masa molar tiene unidades de g/mol.
Acaba de mencionarse una de las masas molares más conocidas: la del agua, 18 g/mol. Quienes se familiarizan con estos cálculos, llegan a un punto en el que son capaces de memorizar algunas masas molares sin necesidad de buscarlas o calcularlas como se hizo arriba. Algunas de estas masas molares, que sirven como ejemplos, son las siguientes:
-O2: 32 g/mol
-N2: 28 g/mol
-NH3: 17 g/mol
-CH4: 16 g/mol
-CO2: 44 g/mol
-HCl: 36,5 g/mol
-H2SO4: 98 g/mol
-CH3COOH: 60 g/mol
-Fe: 56 g/mol
Nótese que los valores dados están redondeados. Para propósitos más precisos, se deben expresar las masas molares con más decimales y calcularlas con las debidas y exactas masas atómicas relativas.
Mediante métodos analíticos, se estimó que una solución de una muestra contiene 0,0267 moles de un analito D. Asimismo, se sabe que su masa corresponde al 14% de una muestra cuya masa total es de 76 gramos. Calcule la masa molar del supuesto analito D.
Debemos determinar la masa de D que está disuelta en la solución. Procedemos:
Masa (D) = 76 g·0,14 = 10,64 g D
Es decir, calculamos el 14% de los 76 gramos de la muestra, los cuales corresponden a los gramos del analito D. Luego, y por último, aplicamos la definición de la masa molar, ya que disponemos de los datos suficientes para calcularla:
M(D) = 10,64 g D/ 0,0267 moles D
=398,50 g/mol
Lo que se traduce como: un mol (6.022·1023) de moléculas de Y tiene una masa igual a 398,50 gramos. Gracias a este valor podemos saber cuánto de Y queremos pesar en la balanza en caso de que deseáramos, por ejemplo, preparar una solución de una concentración molar de 5·10-3 M; esto es, disolver 0,1993 gramos de Y en un litro de solvente:
5·10-3 (mol/L) · (398,50 g/mol) = 0,1993 g Y
Calcule la masa molar del ácido cítrico sabiendo que su fórmula molecular es C6H8O7.
La misma fórmula C6H8O7 facilita la comprensión del cálculo, ya que nos dice de una vez el número de átomos de C, H y O que hay en el ácido cítrico. Por lo tanto, repetimos el mismo paso realizado para con el agua:
6 C · (12,0107) = 72,0642
8 H · (1,008) = 8,064
7 O · (15,999) = 111,993
M(ácido cítrico) = 72,0642 + 8,064 + 111,993
= 192,1212 g/mol
Calcule la masa molar del sulfato de cobre pentahidratado, CuSO4·5H2O.
Conocemos de antes que la masa molar del agua es 18,015 g/mol. Esto nos sirve para simplificar los cálculos, pues la omitimos por el momento y nos enfocamos en la sal anhidra CuSO4.
Tenemos que las masas atómicas relativas del cobre y azufre son 63,546 y 32,065, respectivamente. Con estos datos, procedemos del mismo modo que con el ejercicio 2:
1 Cu · (63,546) = 63,546
1 S · (32,065) = 32,065
4 O · (15,999) = 63,996
M(CuSO4) = 63,546 + 32,065 + 63,996
= 159,607 g/mol
Pero nos interesa la masa molar de la sal pentahidratada, no la anhidra. Para ello, debemos sumarle al resultado la masa correspondiente del agua:
5 H2O = 5 · (18,015) = 90,075
M(CuSO4·5H2O) = 159,607 + 90,075
=249,682 g/mol
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Wikipedia. (2020). Molar mass. Recuperado de: en.wikipedia.org
- Nissa Garcia. (2020). What is Molar Mass? Definition, Formula & Examples. Study. Recuperado de: study.com
- Dr. Kristy M. Bailey. (s.f.). Stoichiometry Tutorial
Finding Molar Mass. Recuperado de: occc.edu - Helmenstine, Anne Marie, Ph.D. (02 de diciembre de 2019). Molar Mass Example Problem. Recuperado de: thoughtco.com
