Butino: qué es, estructura química, propiedades y usos

¿Qué es el butino?
El butino es un compuesto químico que pertenece al grupo de los alquinos, caracterizados principalmente por tener en su estructura al menos un enlace triple entre dos átomos de carbono.
Cuando se trata de establecer reglas para la denominación de los alquinos, la IUPAC (siglas en inglés para Unión Internacional de Química Pura y Aplicada) ha establecido que se utilizan las mismas que para los alquenos.
La diferencia fundamental entre la nomenclatura de ambos tipos de sustancias radica en que el sufijo –eno se cambia a –ino cuando se trata de compuestos que poseen enlaces triples en su estructura.
Por otro lado, el butino está constituido únicamente por carbono e hidrógeno, y se presenta en dos formas: el 1-butino, que se encuentra en fase gaseosa en condiciones de presión y temperatura estándar (1 atm, 25 °C); y el 2-butino, que se encuentra en fase líquida producida mediante síntesis químicas.
Estructura química del butino
En la molécula conocida como butino se presenta el fenómeno de isomería estructural de posición, el cual consiste en la presencia de los mismos grupos funcionales en ambos compuestos, pero cada uno de estos se encuentra en un lugar distinto de la cadena.
En este caso, ambas formas del butino poseen una fórmula molecular idéntica; sin embargo, en el 1-butino el triple enlace se localiza en el carbono número uno, mientras que en el 2-butino se encuentra en el número dos. Esto los convierte en isómeros de posición.
Debido a la ubicación del enlace triple en uno de los terminales de la estructura del 1-butino, este se considera como un alquino terminal, mientras que la posición intermedia del triple enlace en la estructura del 2-butino le otorga la clasificación de alquino interno.
De modo que el enlace solo puede hallarse entre el primer y segundo carbono (1-butino) o entre el segundo y tercer carbono (2-butino). Esto se debe a la nomenclatura aplicada, donde siempre se le dará la numeración más baja posible a la posición del triple enlace.
1-butino
El compuesto llamado 1-butino también se conoce como etilacetileno, debido a su estructura y la manera en que están dispuestos y enlazados sus cuatro átomos de carbono. Sin embargo, cuando se habla de butino se hace referencia únicamente a esta especie química.
En esta molécula, el enlace triple se encuentra en un carbono terminal, lo cual admite la disponibilidad de átomos de hidrógeno que le otorgan una gran reactividad.
Esta unión rígida y más fuerte que un enlace sencillo o doble entre los átomos de carbono le proveen una configuración estable de geometría lineal al 1-butino.
Por otro lado, esta sustancia gaseosa es bastante inflamable, por lo que en presencia de calor puede causar incendios o explosiones fácilmente y posee gran reactividad en presencia de aire o agua.
2-butino
Como los alquinos internos exhiben mayor estabilidad que los alquinos terminales, estos permiten la transformación del 1-butino en 2-butino.
Esta isomerización puede ocurrir mediante el calentamiento del 1-butino en presencia de una base (como NaOH, KOH, NaOCH3…) o a través de la transposición del 1-butino en una solución de hidróxido de potasio (KOH) en etanol (C2H6O).
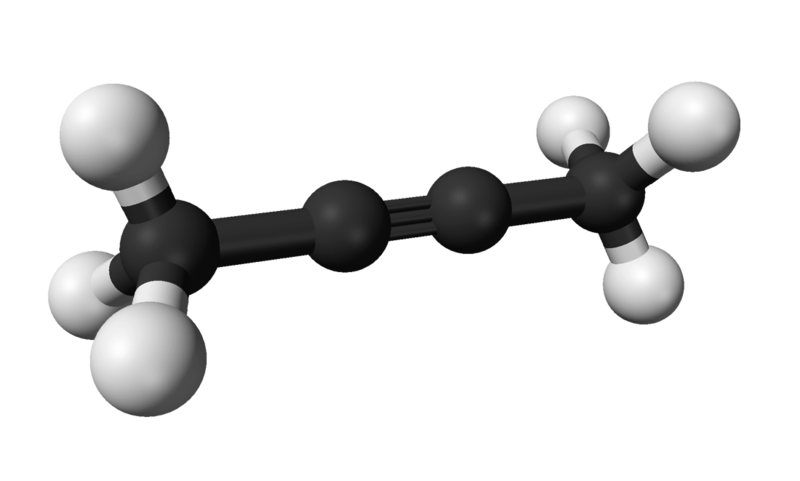
Del mismo modo, la sustancia química conocida como 2-butino también es llamada dimetilacetileno (o crotonileno), presentándose como una especie líquida y volátil que se origina de manera artificial.
En el 2-butino, el enlace triple se encuentra en mitad de la molécula, otorgándole mayor estabilidad que su isómero.
Además, este compuesto incoloro posee una menor densidad que el agua, aunque se considera insoluble en esta y posee una elevada inflamabilidad.
Propiedades del butino
-La fórmula estructural del butino (sin importar a cuál isómero se haga referencia) es C4H6, la cual posee una estructura lineal.
-Una de las reacciones químicas que sufre la molécula de butino es la isomerización, en la cual ocurre un rearreglo y migración del enlace triple dentro de la molécula.
-El 1-butino se encuentra en fase gaseosa, posee una inflamabilidad muy elevada y mayor densidad que el aire.
-Esta sustancia también es bastante reactiva, y en presencia de calor puede causar violentas explosiones.
-Además, cuando este gas incoloro experimenta una reacción de combustión incompleta puede originar monóxido de carbono (CO).
-Cuando ambos isómeros son expuestos a altas temperaturas pueden experimentar reacciones de polimerización de tipo explosivo.
-El 2-butino se encuentra en fase líquida, aunque también se considera bastante inflamable en condiciones estándares de presión y temperatura.
-Estas sustancias pueden experimentar reacciones violentas cuando están en presencia de sustancias oxidantes fuertes.
-Del mismo modo, cuando se hallan en presencia de especies reductoras ocurren reacciones exotérmicas con una consecuente liberación de hidrógeno gaseoso.
-Al entrar en contacto con determinados catalizadores (como algunas sustancias ácidas) o especies iniciadoras, es posible que ocurran reacciones de polimerización de tipo exotérmico.
Usos del butino
Debido a que poseen algunas propiedades diferentes, ambos isómeros pueden presentar usos y aplicaciones distintas, como se muestra a continuación:
En primer lugar, con mucha frecuencia una de las aplicaciones del 1-butino es su utilización como etapa intermedia en el proceso de producción de otras sustancias de naturaleza orgánica de origen sintético.
Por otro lado, esta especie química se emplea en la industria de fabricación del caucho y compuestos derivados; como por ejemplo, cuando se desea obtener benzol.
De manera similar, es empleado en el proceso de manufactura de una gran variedad de productos plásticos, así como en la elaboración de muchas sustancias polietilénicas consideradas de alta densidad.
El 1-butino también se utiliza frecuentemente como componente para los procedimientos de cortado y soldadura de algunas aleaciones de metales, entre ellos el acero (aleación de hierro y carbono).
Por su parte, el isómero 2-butino es empleado en combinación con otro alquino llamado propino en la síntesis de algunas sustancias conocidas como hidroquinonas alquiladas, cuando se realiza el proceso de síntesis total del α-tocoferol (vitamina E).
Referencias
- Wikipedia (s.f.). Butyne. Recuperado de en.wikipedia.org
- Yoder, C. H., Leber P. A. y Thomsen, M. W. (2010). The Bridge to Organic Chemistry: Concepts and Nomenclature. Recuperado de books.google.co.ve
- Study.com (s.f.). Butyne: Structural Formula & Isomers. Obtenido de study.
- PubChem (s.f.). 1-Butyne. Recuperado de pubchem.ncbi.nlm.nih.gov
- PubChem (s.f.). 2-Butyne. Obtenido de pubchem.ncbi.nlm.nih.gov
