Fulminato de mercurio: estructura, propiedades, obtención, usos
El fulminato de mercurio es un compuesto inorgánico formado por los elementos mercurio (Hg), carbono (C), nitrógeno (N) y oxígeno (O). Su fórmula química es Hg(CNO)2. No debe confundirse con el cianato de mercurio, pues aunque ambos compuestos poseen los mismos elementos, en este último los átomos se unen de manera diferente.
Fue descubierto por el químico empírico inglés Edward Howard en 1800. Sin embargo, casi 200 años antes había sido accidentalmente sintetizado por el alquimista alemán Johannes Kunckel, quien por la explosión ocurrida no lo aisló, pero dejó registros escritos de los ingredientes utilizados.
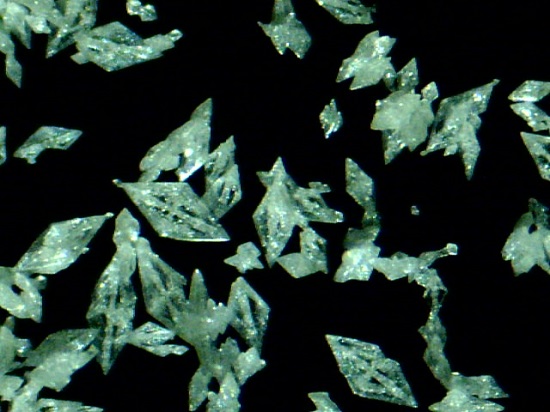
Es un explosivo primario, por lo que se utiliza en cápsulas de percusión o voladura para promover la explosión de otras sustancias. Aunque su preparación y conservación es sumamente peligrosa, fue muy utilizado en el siglo XIX como detonador en armas bélicas y de caza.
Actualmente se emplea para la detonación de potentes cargas de dinamita en la construcción de túneles y carreteras y en minería.
Claramente es un compuesto extremadamente peligroso que solo puede ser manipulado por personas con profundos conocimientos sobre cómo manejar explosivos.
Índice del artículo
- 1 Estructura
- 2 Nomenclatura
- 3 Propiedades
- 4 Obtención
- 5 Uso como agente detonador de otros explosivos
- 6 Riesgos
- 7 Referencias
El Hg(CNO)2 es una sal del ácido fulmínico HCNO. Contiene mercurio en estado de oxidación +2 y dos unidades de fulminato CNO–.
Según un estudio de rayos X realizado en el año 2007 en Alemania (reportado en inglés en 2008), las moléculas de fulminato de mercurio poseen la estructura ONC-Hg-CNO, donde se observa que el mercurio está unido directamente a los átomos de carbono.
La unión C-Hg-C es lineal; forma un ángulo de 180° y el grupo fulminato (CNO) tiene un enlace corto carbono-nitrógeno y un enlace más largo de nitrógeno-oxígeno.
La longitud del enlace C-N es 1,14-1,17 Å (angstroms), lo que corresponde a un enlace triple débil. El enlace N-O es de 1,20-1,25 Å que indica un enlace doble débil. Un angstrom (Å) es una medida de longitud y es la diezmillonésima parte de un metro.
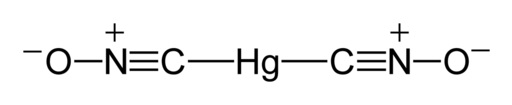
En estado sólido aunque la unión C-Hg-C es lineal y el grupo CNO también lo es, la unión N-C-Hg se desvía de la linealidad en 11°, es decir, tiene un ángulo de 169°.
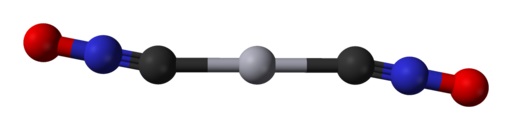
Sin embargo, de acuerdo con el estudio mencionado, en estado gaseoso la molécula completa es totalmente lineal.
- Fulminato de mercurio
- Fulminato mercúrico
- Difulminato de mercurio
- Bisfulminato de mercurio
- Sal de mercurio del ácido fulmínico
- Mercurio fulminante
- Mercurio explosivo
Sólido cristalino blanco a naranja.

284,63 g/mol
No funde. Al ser calentado a más de unos 100 °C explota.
4,42 g/cm3
Ligeramente soluble en agua. Soluble en etanol (C2H5OH) y en hidróxido de amonio (NH4OH).
Es un compuesto muy explosivo y altamente sensible a golpes, impactos o fricción. Puede detonar fácilmente con chispas y llamas. Cuando se descompone forma gases de mercurio (Hg), monóxido de carbono (CO) y nitrógeno (N2).
Con ácido sulfúrico (H2SO4) concentrado también ocurre una violenta detonación. El ácido clorhídrico lo disuelve parcialmente y se produce cloruro mercúrico.
Según un estudio realizado en 1981, si se somete a calentamiento controlado y muy lento, bajo una atmósfera inerte de argón, al llegar a 120 °C ocurre una descomposición no explosiva y se forman óxido mercúrico sólido y gases de mercurio y oxígeno.
Es un compuesto que por su peligrosidad ha sido estudiado en pocas ocasiones y tales oportunidades de estudio han estado muy distanciadas entre sí en el tiempo. Debe trabajarse en la oscuridad para evitar explosiones. Sus muestras deben conservarse bajo el agua y sin luz.

Tras su descubrimiento se producía comercialmente a través de las reacciones entre el etanol (CH3CH2OH), el mercurio (Hg) y el ácido nítrico (HNO3).
En uno de los estudios más importantes sobre la estructura de este compuesto, los investigadores sugieren que para obtener un mayor rendimiento durante su preparación, la primera mitad del volumen total de etanol debe agregarse a la mezcla de Hg y HNO3 antes de que los gases de color marrón desaparezcan.
En otras palabras, es importante que estén presentes los óxidos de nitrógeno para que la reacción proceda.
Lo que ocurre primero es la conversión del etanol en acetaldehído. Según ciertos estudios, luego sigue más oxidación, nitración, descarboxilación y eliminación de ácido nitroso para que se forme el fulminato.
Los primeros intentos de utilizar el fulminato de mercurio como polvo explosivo para las armas de fuego quedaron frustrados por la extraordinaria velocidad y violencia de su detonación.
Las pistolas y escopetas quedaban destrozados por pequeñas cargas de este compuesto. Igualmente sucedía con piezas de artillería y granadas en pruebas militares.
Sin embargo, en 1822 el inglés Wright lo utilizó por primera vez como percutor en sus fusiles de caza deportiva. Posteriormente en Bretaña se implementó su uso en los mosquetes de infantería y luego en toda Europa.

Hasta principios de los años 1900 fue el único detonador utilizado para el disparo de proyectiles de cualquier tipo, hasta que se implementaron otras alternativas con compuestos más seguros y accesibles.
Este compuesto ha jugado un papel importante en el desarrollo de explosivos para propósitos pacíficos.
Su rol en la invención de la dinamita por Alfred Nobel fue muy significativo. Este científico combinó la nitroglicerina, un poderoso explosivo, con un material poroso, la tierra de diatomeas. Pero la detonación de esta mezcla es dificultosa con chispas o mechas.
Nobel superó esta dificultad utilizando cartuchos percutores de fulminato de mercurio que resultaron confiables en su aplicación. Esta combinación permite actualmente su utilización en minería, explotación de canteras, construcción de túneles y en ingeniería civil para la construcción de carreteras, vías de ferrocarriles, puertos, etc.

El mismo Alfred Nobel enfatizó la importancia fundamental del fulminato de mercurio en los desarrollos de ingeniería civil que impulsó la dinamita.
Es un compuesto muy inestable y extremadamente explosivo.

Produce toxicidad aguda. Es tóxico si es ingerido, inhalado o si entra en contacto con la piel. Produce fácilmente dermatitis por contacto. Causa daño a los órganos internos si la persona se expone de forma repetitiva o prolongada.
Muy tóxico para la vida acuática y terrestre con peligro continuado a largo plazo.
- Lide, D.R. (editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- U.S. National Library of Medicine. (2019). Mercury difulminate. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Munroe, C.E. (1912). Note on the production of mercury fulminate. Journal of Industrial & Engineering Chemistry 1912, 4, 2, 152-153. Recuperado de pubs.acs.org.
- Kurzer, F. (2000). Fulminic Acid in the History of Organic Chemistry. J Chem. Educ. 2000, 77, 7, 851. Recuperado de pubs.acs.org.
- Beck, W. and Klapötke, T.M. (2008). Mercury fulminate: ONC-Hg-CNO or CNO-Hg-ONC – a DFT study. Journal of Molecular Structure: THEOCHEM 848 (2008) 94-97. Recuperado de sciencedirect.com.
- Wilson, E. (2007). Mercury Fulminate Revealed. Chemical & Engineering News Archive 2007, 85, 36, 10. Recuperado de pubs.acs.org.
- Brown, M.E. and Swallowe, G.M. (1981). The Thermal Decomposition of the Silver(I) and Mercury(II) Salts of 5-Nitrotetrazole and of Mercury(II) Fulminate. Thermochimica Acta, 49 (1981) 333-349. Recuperado de sciencedirect.com.
- Alderson, H.E. (1910). A new vocation dermatosis. Dermatitis Due to Dry Fulminate of Mercury. Cal State J Med 1910 Apr; 8(4):114. Recuperado de ncbi.nlm.nih.gov.
- Wikimedia Foundation (2020). Mercury(II) fulminate. Recuperado de en.wikipedia.org.
