Lactoferrina: estructura y funciones
La lactoferrina, también conocida como apolactoferrina o lactotransferrina, es una glicoproteína producida por muchas especies de mamíferos que tiene la capacidad de unirse y transferir iones de hierro (Fe3+). Se encuentra en gran parte de los fluidos corporales y está relacionada con la proteína plasmática de unión a hierro conocida como “transferrina”.
Fue aislada en 1939 por Sorensen y Sorensen a partir de leche bovina y, casi 30 años más tarde, en 1960, Johannson determinó su presencia en la leche humana (su nombre deriva de su clasificación como la proteína de unión a hierro más abundante de la leche).
Investigaciones posteriores identificaron a la lactoferrina en otras secreciones de glándulas exocrinas como la bilis, el jugo pancreático y las secreciones del intestino delgado, así como en los gránulos secundarios de los neutrófilos, unas células plasmáticas pertenecientes al sistema inmune.
Esta proteína se encuentra también en las lágrimas, la saliva, el semen, los fluidos vaginales, las secreciones bronquiales y nasales y en la orina, aunque es particularmente abundante en la leche (es la segunda proteína en mayor concentración después de la caseína) y el calostro.
Aunque inicialmente se consideraba simplemente como una proteína con actividad bacteriostática de la leche, se trata de una proteína con gran variedad de funciones biológicas, aunque no todas tienen que ver con su capacidad de transferencia de iones de hierro.
Índice del artículo
- 1 Estructura de la lactoferrina
- 2 Funciones
- 3 Fuentes de lactoferrina en el cuerpo humano
- 4 Referencias
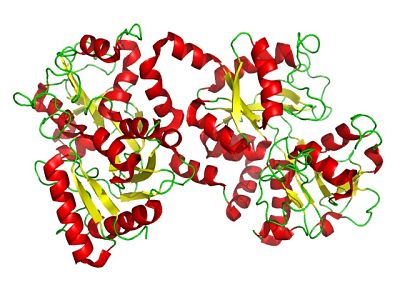
La lactoferrina, como se comentó, es una glucoproteína de alrededor de 80 kDa de peso molecular, la cual está compuesta por 703 residuos aminoacídicos cuya secuencia tiene gran homología entre especies diferentes. Es una proteína básica, cargada positivamente y con un punto isoeléctrico entre 8 y 8.5.
Está formada por una sola cadena polipeptídica que está plegada para formar dos lóbulos simétricos denominados el lóbulo N (residuos 1-332) y el lóbulo C (residuos 344-703) que comparten entre el 33 y el 41% de homología entre sí.
Tanto el lóbulo N como el lóbulo C están formados por láminas β-plegadas y hélices alfa, las cuales constituyen dos dominios por lóbulo, el dominio I y el dominio II (C1, C2, N1 y N2).
Ambos lóbulos están conectados a través de una región “bisagra” que está compuesta por una hélice alfa entre los residuos 333 y 343, lo que le proporciona una mayor flexibilidad molecular a la proteína.
Los análisis de la secuencia aminoacídica de esta proteína revelan gran cantidad de sitios potenciales para la glicosilación. El grado de glicosilación es muy variable y determina la resistencia frente a la actividad de proteasas o a pH considerablemente bajos. El sacárido más común en su porción carbohidratada es la manosa, con más o menos un 3% de azúcares hexosas y 1% de hexosaminas.
Cada lóbulo de la lactoferrina es capaz de unirse reversiblemente a dos iones metálicos, bien sean de hierro (Fe2+, Fe3+), de cobre (Cu2+), de zinc (Zn2+), de cobalto (Co3+) o de manganeso (Mn2+), en sinergia con un ion bicarbonato.
También puede unirse, aunque con menor afinidad, a otras moléculas como lipopolisacáridos, glucosaminoglicanos, ADN y heparina.
Cuando la proteína está unida a dos iones de hierro se conoce como hololactoferrina, mientras que cuando está en su forma “libre” se denomina apolactoferrina y cuando solo está unida a un átomo de hierro se conoce como lactoferrina monoférrica.
La apolactoferrina tiene una conformación abierta, entretanto la hololactoferrina tiene una configuración cerrada, por lo que es más resistente a la proteólisis.
Algunos autores describen la existencia de tres isoformas de lactoferrina: la α, la β y la γ. La forma lactoferrina-α es denotada como aquella con la capacidad de unión al hierro y sin actividad ribonucleasa. Las formas lactoferrina-β y lactoferrina-γ tienen actividad ribonucleasa, pero no son capaces de unirse a iones metálicos.
La lactoferrina es una glicoproteína con una afinidad para la unión a hierro muy superior a la de la transferrina, una proteína transportadora de hierro en el plasma sanguíneo, lo que le otorga la capacidad de unirse a los iones de este metal en un amplio rango de pH.
En vista de que tiene una carga neta positiva y se distribuye en diversos tejidos, se trata de una proteína multifuncional que está implicada en diversas funciones fisiológicas como:
– La regulación de la absorción intestinal de hierro
– Los procesos de respuesta inmune
– Los mecanismos antioxidantes corporales
– Actúa como agente anticarcinogénico y antiinflamatorio
– Es un agente protector contra infecciones microbianas
– Funciona como factor de transcripción
– Está implicado en la inhibición de proteasas
– Es una proteína antiviral, antifúngica y antiparasitaria
– Funciona también como procoagulante y tiene actividad ribonucleasa
– Es un factor de crecimiento óseo.
Respecto al combate de las infecciones microbianas, la lactoferrina actúa de dos formas:
– Secuestrando el hierro en los sitios de infección (lo que provoca una carencia nutricional en los microorganismos infecciosos, actuando como bacteriostático) o
– Interactuando directamente con el agente infeccioso, lo que puede causar la lisis celular.
La lactoferrina puede ser obtenida directamente al ser purificada a partir de la leche de vaca, pero otros sistemas modernos se basan en su producción como proteína recombinante en distintos organismos de fácil, rápido y económico crecimiento.
Como compuesto activo de algunos fármacos, esta proteína es empleada para el tratamiento de úlceras estomacales e intestinales, así como de diarrea y hepatitis C.
Es empleada en contra de infecciones de origen bacteriano y viral y, además, es utilizada como estimulante del sistema inmune para la prevención de algunas patologías como el cáncer.
La expresión de esta proteína puede detectarse inicialmente en los estadios de dos y cuatro células del desarrollo embrionario y luego en la etapa de blastocisto, hasta el momento de la implantación.
Posteriormente es evidenciada en los neutrófilos y en las células epiteliales de los sistemas digestivo y reproductivo en formación.
La síntesis de esta proteína es llevada a cabo en los epitelios mieloides y secretorios. En un ser humano adulto, los mayores niveles de expresión de lactoferrina son detectados en la leche materna y en el calostro.
También puede hallarse en muchas secreciones mucosas como los fluidos uterinos, seminales y vaginales, en la saliva, la bilis, el jugo pancreático, las secreciones del intestino delgado, las secreciones nasales y las lágrimas. Se ha determinado que los niveles de esta proteína cambian durante el embarazo y durante el ciclo menstrual de las mujeres.
En el año 2000 se determinó la producción de lactoferrina en los riñones, donde es expresada y secretada a través de los túbulos colectores y puede ser reabsorbida en la porción distal de los mismos.
La mayor parte de la lactoferrina plasmática en los seres humanos adultos proviene de los neutrófilos, donde es almacenada en gránulos secundarios específicos y en gránulos terciarios (aunque en menor concentración).
- Adlerova, L., Bartoskova, A., & Faldyna, M. (2008). Lactoferrin: a review. Veterinarni Medicina, 53(9), 457-468.
- Berlutti, F., Pantanella, F., Natalizi, T., Frioni, A., Paesano, R., Polimeni, A., & Valenti, P. (2011). Antiviral properties of lactoferrin—a natural immunity molecule. Molecules, 16(8), 6992-7018.
- Brock, J. (1995). Lactoferrin: a multifunctional immunoregulatory protein? Immunology today, 16(9), 417-419.
- Brock, J. H. (2002). The physiology of lactoferrin. Biochemistry and Cell Biology, 80(1), 1-6.
- González-Chávez, S. A., Arévalo-Gallegos, S., & Rascón-Cruz, Q. (2009). Lactoferrin: structure, function and applications. International journal of antimicrobial agents, 33(4), 301-e1.
- Levay, P. F., & Viljoen, M. (1995). Lactoferrin: a general review. Haematologica, 80(3), 252-267.
- Naot, D., Grey, A., Reid, I. R., & Cornish, J. (2005). Lactoferrin–a novel bone growth factor. Clinical Medicine & Research, 3(2), 93-101.
- Sanchez, L., Calvo, M., & Brock, J. H. (1992). Biological role of lactoferrin. Archives of disease in childhood, 67(5), 657.
