Proteoglicanos: estructura, características, función, ejemplos
¿Qué son los proteoglicanos?
Los proteoglicanos son proteínas glicosiladas, generalmente asociadas con sustituyentes glicosaminoglicanos (GAGs) aniónicos. Usualmente se encuentran en la cara externa de la membrana celular o “llenan” el espacio extracelular, por lo que forman parte de muchos tejidos conectivos.
De estas complejas macromoléculas, las más estudiadas y analizadas han sido las de las células cartilaginosas en los animales vertebrados, puesto que la matriz extracelular en estas comprende más del 90% del peso seco del tejido que componen, donde influyen, entre otras cosas, en la resistencia frente a compresiones.
Estructuralmente, los proteoglicanos contribuyen en la organización de la matriz extracelular, lo que le da a muchos tejidos o células individuales sus propiedades físicas más distintivas. Además, estos son importantes para muchos eventos de señalización y comunicación intercelular.
Son proteínas sumamente abundantes, ubicuas (están en numerosos tipos de células) y complejas, cuyas funciones biológicas y propiedades bioquímicas derivan fundamentalmente de las características de sus componentes carbohidratados, los cuales tienen una gran capacidad de hidratación.
Participan activamente en la comunicación intercelular, en los procesos de adhesión y migración y también han sido implicados en el desarrollo de diversos tejidos en los animales, como por ejemplo las redes perineuronales del sistema nervioso.
Estructura y características de los proteoglicanos
Los proteoglicanos son proteínas glicosiladas de la superficie extracelular, aunque existen algunos que pueden hallarse en compartimentos intracelulares. Son moléculas generalmente muy abundantes, pero su abundancia depende del tipo de célula que se considere.
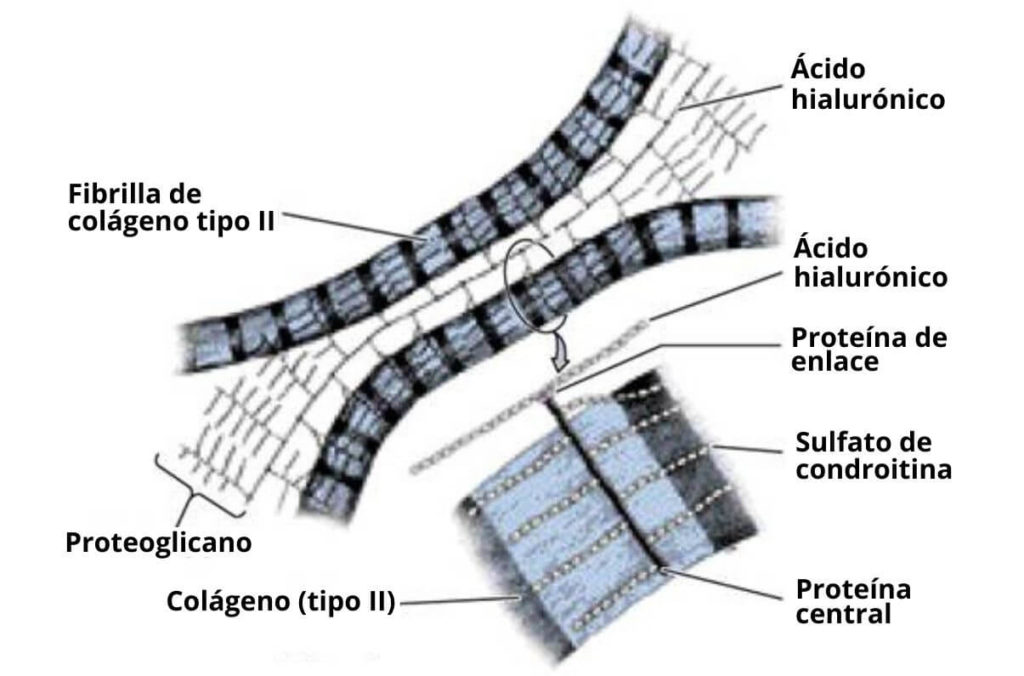
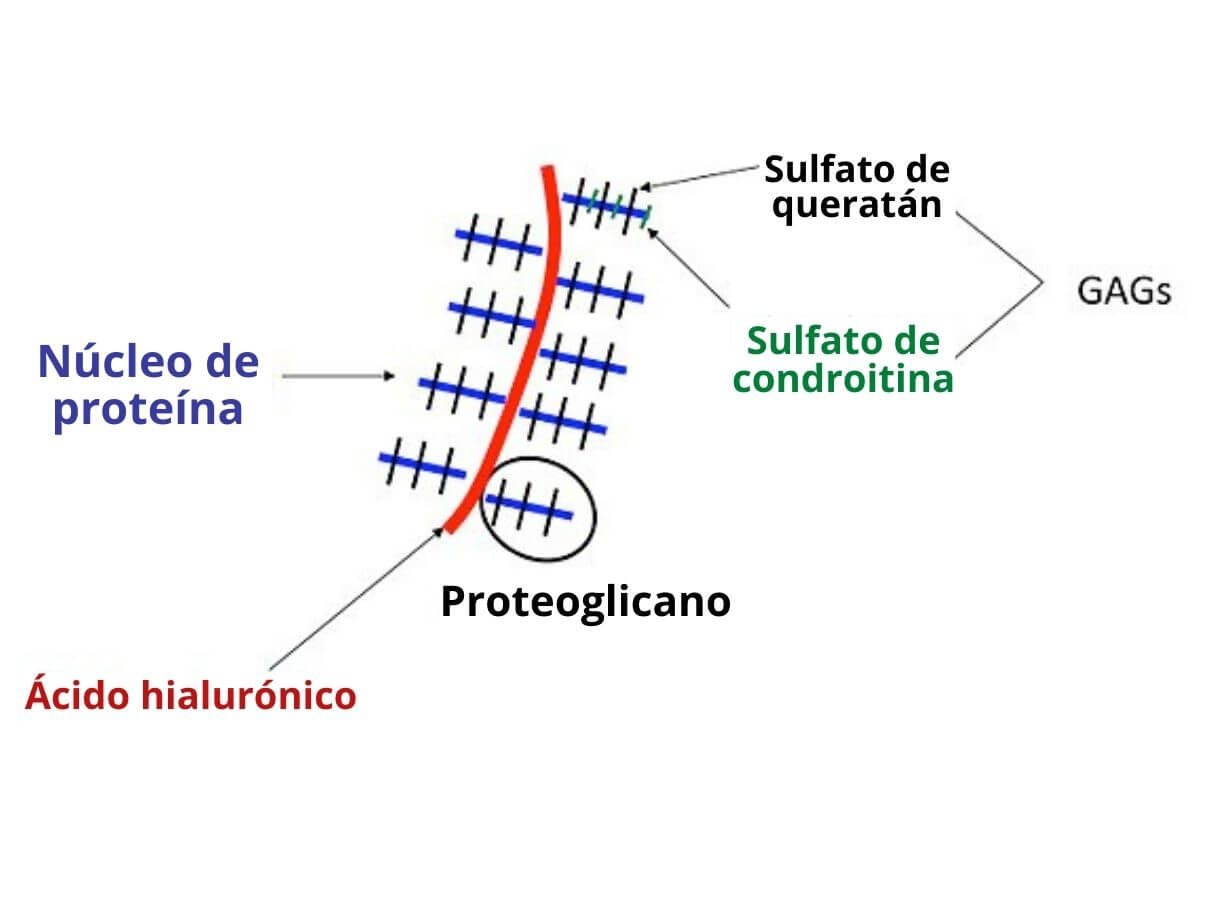
Ordinariamente, la porción carbohidratada de un proteoglicano consiste en moléculas de glicosaminoglicanos, que son polisacáridos lineales compuestos por disacáridos repetidos, usualmente de un aminoazúcar acetilado que se alterna con ácido urónico.
Su estructura general, por lo tanto, consiste en un “núcleo” proteico que puede asociarse con más de 100 cadenas de glucosaminoglicanos no ramificadas, unidas por medio de O-glicosilación.
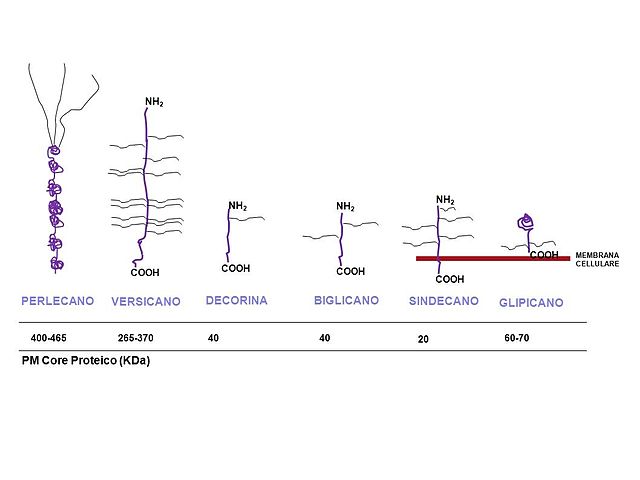
Se trata de moléculas bastante diversas en cuanto a estructura, forma y función. En las células de los animales vertebrados, por ejemplo, se han identificado varias combinaciones de distintos tipos de proteínas y distintas clases de glucosaminoglicanos, a saber:
Proteínas
– Proteínas transmembranales de la superficie celular (matriz extracelular)
– Proteínas unidas covalentemente a anclas de glicosilfosfatidilinositol (GPI))
Glucosaminoglicanos
– Hialuronano (HA)
– Condroitín sulfato (CS)
– Keratan sulfato (KS)
– Dermatán sulfato (DS)
– Heparán sulfato (HS)
Algunos proteoglicanos como los sindecanos, que son proteínas transmembranales, están unidas a 2 cadenas de heparán sulfato y 1 de condroitín sulfato; entretanto otro proteoglicano, el agrecano (específico de cartílago) tiene cerca de 100 cadenas de condroitina sulfato y 30 de keratan sulfato.
De lo anterior se entiende que las características de glicosilación de cada proteína, así como el tipo de célula a la que pertenece, son las que definen la identidad de cada proteoglicano en la superficie celular.
Función
De las características estructurales de los proteoglicanos dependen sus funciones. Esto es particularmente cierto para aquellas características que se relacionan con la porción glucosaminoglicano, pues estas moléculas son las que le permiten a la proteína interactuar con otros elementos en la superficie celular.
Aquellas proteínas ricas en residuos de heparán sulfato pueden unirse con relativa facilidad a distintos factores de crecimiento, a otros componentes de la matriz extracelular, a enzimas, inhibidores de proteasas, quimiocinas, etc., por lo que tienen un papel fundamental en la transducción de señales hacia el medio intracelular.
Así pues, los proteoglicanos pueden cumplir funciones estructurales en la matriz o pueden tener funciones más específicas en la transmisión de mensajes desde el medio extracelular hacia el espacio citosólico.
En los últimos años el interés por el estudio de los proteoglicanos ha crecido considerablemente, hecho que está relacionado con el descubrimiento de la importancia que estas moléculas tienen en algunas condiciones patológicas en los seres humanos.
Un ejemplo de estas es el síndrome de Simpson-Golabi-Behmel (SGBS), caracterizado por un crecimiento pre- y post-natal exagerado, defectos en el nacimiento y susceptibilidad a la formación de tumores asociados con mutaciones en un proteoglicano rico en heparán sulfato y anclado mediante GPI.
Funciones celulares
Prácticamente todos los procesos celulares que implican interacciones moleculares en la superficie celular, tales como interacciones célula-matriz, célula-célula y ligando-receptor tienen que ver, de una u otra manera, con proteoglicanos, pues estas son capaces de unirse a gran cantidad de otras moléculas y son considerablemente abundantes en la superficie.
Durante el desarrollo del sistema nervioso y también durante la invasión de un tumor y la metástasis, es decir, eventos que tienen que ver con movimientos y prolongaciones o extensiones celulares, los proteoglicanos ejercen funciones muy activas.
Estas proteínas glicosiladas también participan en los procesos de adhesión, proliferación y establecimiento de la forma celular y aquellas que son proteínas transmembranales que poseen un dominio citosólico, participan en cascadas de transducción y señalización.
Ejemplos de proteoglicanos
Agrecano
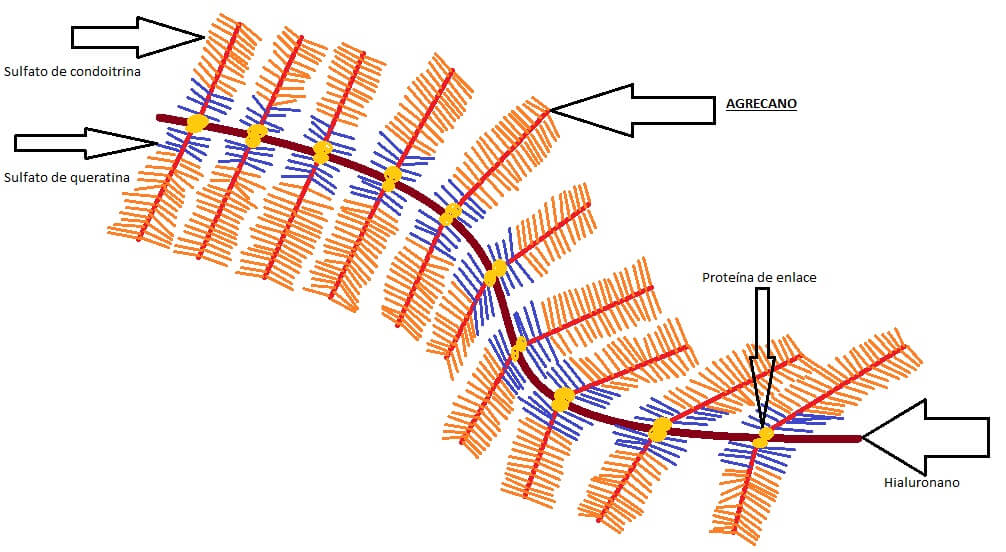
El agrecano es el principal proteoglicano presente en el tejido cartilaginoso, el cual se asocia con fragmentos del glicosaminoglicano “hialuronano” (HA) en la matriz extracelular de los condrocitos.
El hialuronano es un glucosaminoglicano lineal compuesto por residuos alternados de ácido glucorónico y N-acetilglucosamina, que puede hallarse tanto en la superficie celular como en la matriz extracelular y en el interior de las células.
La unión del hialuronano al agrecano ocurre a través de una “proteína de unión” que forma importantes agregados con pesos moleculares de hasta varios millones de daltons.
Muchas enfermedades articulares relacionadas con el progreso de la edad tienen que ver con el aumento en la agregación del agrecano y el hialuronano.
Pelecano
En los glomérulos renales, la membrana basal está conformada principalmente por un proteoglicano conocido como pelecano, que se asocia con porciones de heparán sulfato. Este proteoglicano tiene importantes funciones como sitio aniónico de selectividad de cargas durante la filtración glomerular.
Este proteoglicano tiene el núcleo proteico más grande que se ha observado en cualquiera de estas moléculas y se especula que este dominio proteico pueda interactuar con otras macromoléculas presentes en la membrana basal.
Decorina
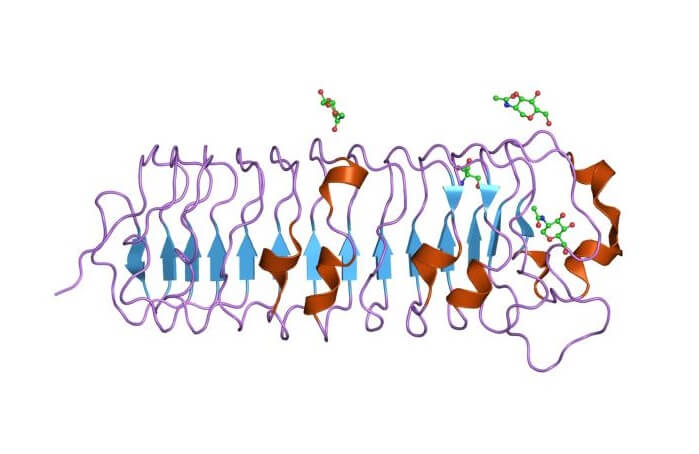
La decorina es un proteoglicano intersticial de pequeño tamaño y se caracteriza por tener una sola cadena de glucosaminoglicano y un pequeño núcleo proteico. Es un componente importante de muchos tejidos conectivos, se une a fibras de colágeno tipo I y participa en el ensamblaje de la matriz extracelular.
