Cetogénesis: tipos de cuerpos, síntesis y degradación
La cetogénesis es el proceso por el cual se obtiene el acetoacetato, β-hidroxibutirato y acetona, que en conjunto se denominan cuerpos cetónicos. Este mecanismo complejo y finamente regulado se lleva a cabo en las mitocondrias, a partir del catabolismo de los ácidos grasos.
La obtención de los cuerpos cetónicos tiene lugar cuando el organismo es sometido a períodos exhaustivos de ayuno. Aunque estos metabolitos son sintetizados mayormente en las células hepáticas, se encuentran como fuente importante de energía en variados tejidos, como en el músculo esquelético y en tejidos cardíacos y cerebrales.
El β-hidroxibutirato y acetoacetato son metabolitos usados como sustratos en el músculo cardíaco y la corteza del riñón. En el cerebro, los cuerpos cetónicos pasan a ser fuentes importantes de energía cuando el organismo ha agotado su reserva de glucosa.
Índice del artículo
- 1 Características generales
- 2 Tipos y propiedades de los cuerpos cetónicos
- 3 Síntesis de cuerpos cetónicos
- 4 Degradación
- 5 Relevancia médica de los cuerpos cetónicos
- 6 Referencias
La cetogénesis se considera una función fisiológica o ruta metabólica muy importante. Generalmente, este mecanismo se lleva a cabo en el hígado, aunque se ha demostrado que puede efectuarse en otros tejidos capaces de metabolizar ácidos grasos.
La formación de los cuerpos cetónicos es la principal derivación metabólica del acetil-CoA. Dicho metabolito se obtiene a partir de la ruta metabólica conocida como β-oxidación, que es la degradación de los ácidos grasos.
La disponibilidad de glucosa en los tejidos donde ocurre la β-oxidación determina el destino metabólico del acetil-CoA. En situaciones particulares los ácidos grasos oxidados se dirigen casi en su totalidad a la síntesis de cuerpos cetónicos.
El principal cuerpo cetónico es el acetoacetato o ácido acetoacético, que se sintetiza mayormente en las células hepáticas. A partir del acetoacetato se derivan las demás moléculas que conforman los cuerpos cetónicos.
La reducción del ácido acetoacético da origen al D-β-hidroxibutirato, el segundo cuerpo cetónico. La acetona es un compuesto difícil de degradar y se produce por una reacción espontánea de descarboxilación del acetoacetato (por lo que no requiere intervención de ninguna enzima), cuando este está presente en altas concentraciones en sangre.
La denominación de cuerpos cetónicos se ha dispuesto por convención, ya que estrictamente hablando el β-hidroxibutirato no tiene una función cetónica. Estas tres moléculas son solubles en agua lo que facilita su transporte en sangre. Su función principal es proveer energía a ciertos tejidos como músculo esquelético y cardíaco.
Las enzimas que intervienen en la formación de los cuerpos cetónicos están principalmente en las células hepáticas y de los riñones, lo que explica que sean estas dos locaciones las principales productoras de dichos metabolitos. Su síntesis ocurre única y exclusivamente en la matriz mitocondrial de las células.
Una vez sintetizadas estas moléculas, pasan al torrente sanguíneo dirigiéndose a los tejidos que los requieran, donde se degradan hasta acetil-CoA.
El destino metabólico del acetil-CoA proveniente de la β-oxidación depende de los requerimientos metabólicos del organismo. Este se oxida hasta CO2 y H2O por la vía del ciclo del ácido cítrico o la síntesis de ácidos grasos, si el metabolismo de lípidos y glúcidos está estable en el organismo.
Cuando el organismo necesita la formación de glúcidos, el oxalacetato es usado para la fabricación de glucosa (gluconeogénesis) en vez de dar inicio al ciclo del ácido cítrico. Esto ocurre, como se ha mencionado, cuando el organismo tiene alguna incapacidad para obtener glucosa, en casos como ayuno prolongado o la presencia de diabetes.
Debido a esto el acetil-CoA resultante de la oxidación de ácidos grasos es utilizado para la producción de los cuerpos cetónicos.
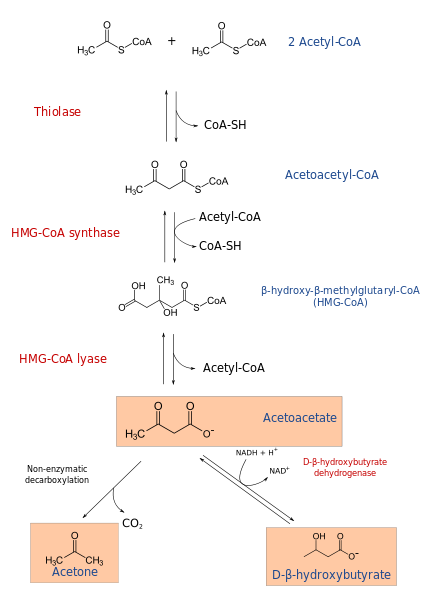
El proceso de cetogénesis comienza a partir de los productos de la β-oxidación: acetacetil-CoA o acetil-CoA. Cuando el sustrato es el acetil-CoA, el primer paso consiste en la condensación de dos moléculas, reacción catalizada por acetil-CoA transferasa, para producir acetacetil-CoA.
El acetacetil-CoA se condensa con un tercer acetil-CoA mediante la acción de la HMG-CoA sintasa, para producir HMG-CoA (β-hidroxi- β-metilglutaril-CoA). El HMG-CoA se degrada hasta acetoacetato y acetil-CoA por acción de HMG-CoA liasa. De esta forma se obtiene el primer cuerpo cetónico.
El acetoacetato se reduce hasta β-hidroxibutirato por la intervención de β-hidroxibutirato deshidrogenasa. Esta reacción depende de NADH.
El principal cuerpo cetónico acetoacetato es un β-cetoácido, que experimenta descarboxilación no enzimática. Este proceso es sencillo y produce acetona y CO2.
Esta serie de reacciones da lugar así a los cuerpos cetónicos. Estos al ser solubles en agua pueden ser transportados de forma sencilla a través de la circulación sanguínea, sin necesidad de anclarse a una estructura de albumina, como es el caso de los ácidos grasos que son insolubles en medio acuoso.
El metabolismo de ácidos grasos produce los sustratos para la cetogénesis, por lo que estas dos vías están funcionalmente relacionadas.
La acetoacetil-CoA es un inhibidor del metabolismo de los ácidos grasos, ya que detiene la actividad de la acil-CoA deshidrogenasa que es la primera enzima de la β-oxidación. Además, ejerce también inhibición sobre la acetil-CoA transferasa y la HMG-CoA sintasa.
La enzima HMG-CoA sintasa, supeditada por la CPT-I (enzima involucrada en la producción de acil carnitina en la β-oxidación), representa un papel regulador importante en la formación de ácidos grasos.
La alimentación de los organismos regula un complejo conjunto de señales hormonales. Los carbohidratos, aminoácidos y lípidos consumidos en la dieta se depositan en forma de triacilgliceroles en el tejido adiposo. La insulina, una hormona anabólica, interviene en la síntesis de los lípidos y la formación de triacilgliceroles.
A nivel mitocondrial, la β-oxidación es controlada por el ingreso y participación de algunos sustratos en la mitocondria. La enzima CPT I sintetiza Acil Carnitina a partir de Acil CoA citosólico.
Cuando el organismo está alimentado, se activa el Acetil-CoA carboxilasa y el citrato aumenta los niveles de CPT I, mientras que disminuye su fosforilación (reacción dependiente de AMP cíclico).
Esto causa una acumulación de malonil CoA, que estimula la síntesis de ácidos grasos y bloquea su oxidación, evitando que se genere un ciclo fútil.
En el caso de ayuno, la actividad de la carboxilasa es muy baja pues los niveles de la enzima CPT I se han reducido y además se ha fosforilado, activándose e impulsando la oxidación de lípidos, que posteriormente permitirá la formación de los cuerpos cetónicos a través de la acetil-CoA.
Los cuerpos cetónicos se difunden fuera de las células donde se sintetizaron y son transportados hacia los tejidos periféricos por la corriente sanguínea. En dichos tejidos pueden ser oxidados a través del ciclo de los ácidos tricarboxílicos.
En los tejidos periféricos el β-hidroxibutirato se oxida a acetoacetato. Ulteriormente el acetoacetato presente se activa por acción de la enzima 3-cetoacil-CoA transferasa.
El succinil-CoA actúa como donador de CoA convirtiéndose en succinato. La activación del acetoacetato ocurre para evitar que el succinil-CoA se convierta en succinato en el ciclo del ácido cítrico, con la síntesis acoplada de GTP por la acción de la succinil-CoA sintasa.
El acetoacetil-CoA resultante sufre una ruptura tiolítica produciendo dos moléculas de acetil-CoA que se incorporan en el ciclo de los ácidos tricarboxílicos, mejor conocido como ciclo de Krebs.
Las células hepáticas carecen de la 3-cetoacil-CoA transferasa, evitando que se active este metabolito en dichas células. De esta forma se garantiza que los cuerpos cetónicos no se oxiden en las células donde fueron producidos, sino que puedan ser trasladados a los tejidos donde se requiera de su actividad.
En el cuerpo humano, altas concentraciones de cuerpos cetónicos en la sangre pueden ocasionar condiciones especiales denominadas acidosis y cetonemia.
La fabricación de estos metabolitos corresponde al catabolismo de los ácidos grasos y de los hidratos de carbono. Una de las causas más comunes de una condición de cetogénesis patológica es la alta concentración de fragmentos dicarbonados acéticos que no se degradan por la ruta de oxidación de ácidos tricarboxílicos.
Como consecuencia se registra un aumento en los niveles de los cuerpos cetónicos en sangre por encima de 2 a 4 mg/100 N y su presencia en la orina. Esto se traduce en la perturbación del metabolismo intermediario de dichos metabolitos.
Ciertos defectos en los factores neuroglandulares hipofisarios que regulan la degradación y síntesis de los cuerpos cetónicos, junto a trastornos en el metabolismo de hidrocarburos, son causantes de la condición de hipercetonemia.
La diabetes mellitus (tipo 1) es una enfermedad endocrina que causa un aumento en la producción de cuerpos cetónicos. La producción inadecuada de insulina inhabilita el transporte de la glucosa hacia los músculos, hígado y tejido adiposo, acumulándose así en la sangre.
Las células en ausencia de glucosa comienzan el proceso de gluconeogénesis y degradación de grasa y proteínas para restablecer su metabolismo. Como consecuencia disminuyen las concentraciones de oxalacetato y aumenta la oxidación de lípidos.
Ocurre entonces una acumulación de acetil-CoA, que en ausencia del oxalacetato no puede seguir la vía del ácido cítrico, ocasionando entonces las altas producciones de los cuerpos cetónicos, característica de esta enfermedad.
La acumulación de acetona se detecta por su presencia en la orina y en el aliento de las personas que presentan esta condición, y es de hecho uno de los síntomas que indican la manifestación de esta enfermedad.
- Blázquez Ortiz, C. (2004). Cetogénesis en astrocitos: caracterización, regulación y posible papel citoprotector (Doctoral dissertation, Universidad Complutense de Madrid, Servicio de Publicaciones).
- Devlin, T. M. (1992). Textbook of biochemistry: with clinical correlations.
- Garrett, R. H., & Grisham, C. M. (2008). Biochemistry. Thomson Brooks/Cole.
- McGarry, J. D., Mannaerts, G. P., & Foster, D. W. (1977). A possible role for malonyl-CoA in the regulation of hepatic fatty acid oxidation and ketogenesis. The Journal of clinical investigation, 60(1), 265-270.
- Melo, V., Ruiz, V. M., & Cuamatzi, O. (2007). Bioquímica de los procesos metabólicos. Reverte.
- Nelson, D. L., Lehninger, A. L., & Cox, M. M. (2008). Lehninger principles of biochemistry. Macmillan.
- Pertierra, A. G., Gutiérrez, C. V., & Otras, C. M. (2000). Fundamentos de bioquímica metabólica. Editorial Tébar.
- Voet, D., & Voet, J. G. (2006). Bioquímica. Ed. Médica Panamericana.
