Fuerza iónica: unidades, cómo calcularla, ejemplos
La fuerza iónica es una forma de expresar la concentración de los iones en una solución. Este concepto fue introducido en 1922 por Lewis y Randall mientras trabajaban en la descripción del coeficiente de actividad química.
Cuando la concentración de los iones en una solución es alta, se produce una interacción electrostática entre los iones con carga opuestas; es decir, los cationes y aniones se atraen con mucha fuerza, lo que trae como consecuencia que la concentración iónica efectiva o real sea menor que la calculada para una reacción química en particular.

Por esta razón, se introdujo el concepto de actividad química como la concentración iónica efectiva de una solución, siendo la actividad química el producto de la molaridad de la solución por el coeficiente de actividad química.
Este coeficiente tiene un valor cercano a la unidad (1) para las soluciones iónicas diluidas y para las llamadas soluciones ideales. Estas son soluciones donde la interacción intermolecular entre las moléculas similares, es igual a la existente entre moléculas distintas.
La creación del concepto de fuerza iónica contribuyó a la explicación de las desviaciones del comportamiento ideal, observadas en las soluciones iónicas reales.
Índice del artículo
- 1 Unidades de la fuerza iónica
- 2 ¿Cómo calcular la fuerza iónica?
- 3 Importancia de la fuerza iónica
- 4 Ejemplos de fuerzas iónicas
- 5 Referencias
La fuerza iónica tiene como unidades moles/L (molaridad) o moles/Kg de agua (molalidad). Se recomienda esta última en las soluciones no ideales, los cuales se caracterizan porque los volúmenes de sus mezclas no son totalmente aditivos.
Esto significa, por ejemplo, lo siguiente: si se mezclan 0.5 litros de un líquido A y 0.5 litros de un líquido B, el volumen resultado de esta mezcla, no será necesariamente igual a 1 litro, sino que puede ser distinto.
La fuerza iónica viene representada por el símbolo I.
Para el cálculo de la fuerza iónica de una solución se toman en cuenta la concentración de todos los iones presentes en la solución, así como sus respectivas valencias.
El valor de la fuerza iónica se obtiene mediante la aplicación de la fórmula siguiente:
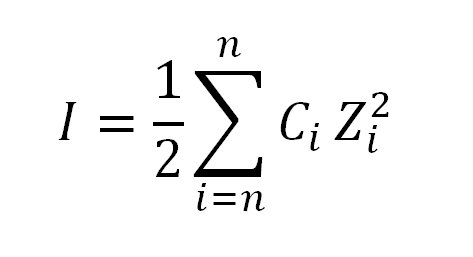
Donde I, como ya se ha dicho, es la fuerza iónica; C, corresponde a la concentración iónica molar o molal de los iones; mientras que Z, representa sus respectivas valencias (±1, ±2, ±3, etc.).
La expresión que aparece en la fórmula en el cálculo de la fuerza iónica (Σ) se lee como sumatoria, es decir, la suma del producto de la concentración molar (C) de cada ión presente en la solución por su valencia (Z) elevada al cuadrado.
Como se podrá notar, la valencia del ión tiene el mayor peso en el valor de la fuerza iónica de la solución. Por ejemplo: la valencia (Z) del Ca es +2, por lo que Z2 es igual 4. Mientras, la valencia (Z) del Na es +1, y por lo tanto, Z2 es igual 1.
Esto señala, que la contribución del ion Ca2+ al valor de la fuerza iónica, a una misma concentración iónica molar, es cuatro veces mayor que la del ion Na+.
La fuerza iónica es una medida adecuada de la concentración iónica de una solución y es la base del establecimiento de la Teoría de Debye-Hückel. Esta teoría describe el comportamiento ideal de las soluciones iónicas.
La fuerza iónica sirve de base para el cálculo del coeficiente de actividad (γi), parámetro que a su vez permite el cálculo de la actividad química de un compuesto iónico, siendo la actividad química la concentración efectiva y real de un compuesto iónico en solución.
Al aumentar la fuerza iónica de una solución, aumenta la interacción entre los iones. Por lo tanto, disminuye γi y la actividad química de los iones.
Un aumento de la fuerza iónica puede disminuir la solubilidad de las proteínas en un medio acuoso, siendo esta propiedad usada para la precipitación de proteínas en forma selectiva. Se usan soluciones de sulfato de amonio de alta fuerza iónica para la precipitación y purificación de las proteínas plasmáticas.
Calcular la fuerza iónica de una solución de cloruro de potasio (KCl) 0.3 M.
El KCl se disocia en la siguiente forma:
KCl → K+ + Cl–
Tenemos pues, dos iones: el catión K+ (Z =+1) y el anión Cl– (Z=-1). Aplicamos entonces la fórmula para calcular la fuerza iónica I:
I = 1/2 [C · (+1)1 + C · (-1)1]
= 1/2 [0.3 M · 11 + 0.3 M · 11]
= 0.3 M
Nótese que la valencia -1 del Cl– se tomo como 1, su valor absoluto, ya que de lo contrario la fuerza iónica sería igual a 0.
Calcular la fuerza iónica de una solución de sulfato de calcio (CaSO4) 0.5 M
El CaSO4 se disocia de la siguiente forma:
CaSO4 → Ca2+ + SO42-
Tenemos dos iones: el catión Ca2+ (Z =+2) y el anión SO42- (Z=-2). Aplicamos entonces la fórmula para calcular la fuerza iónica I:
I = 1/2 [C · (+2)2 + C · (-2)2]
= 1/2 [0,5 M · 4 + 0,5 M · 4]
= 2 M
Calcular la fuerza iónica de un amortiguador con las concentraciones finales de fosfato de sodio dibásico (Na2HPO4) 0.3 M y de fosfato de sodio monobásico (NaH2PO4) 0.4 M.
El Na2HPO4 se disocia de la siguiente forma:
Na2HPO4 → 2Na+ + HPO42-
Mientras que el NaH2PO4 se disocia siguiendo el patrón siguiente:
NaH2PO4 → Na+ + H2PO4–
Procedemos como los ejercicios anteriores, teniendo esta vez los aniones HPO42- (Z= -2) y H2PO4– (Z= -1):
I = 1/2 {[C · 2 · (+1)1 + C · (-2)2] + [C · (+1)1 + C · (-1)1]}
= 1/2 {[0.3 M · 2 · 1 + 0.3 M · 4] + [0.4 M · 1 + 0.4 M · 1]}
= 1/2 {[0.6 M + 1.2 M] + [0.4 M + 0.4 M]}
= 1.3 M
Nótese que la concentración del Na+ proveniente del Na2HPO4 se multiplica por 2, ya que su concentración es el doble. Sin embargo, para la otra sal, NaH2PO4, la concentración del Na+ sí la multiplicamos por 1, de acuerdo a la estequiometría de su ecuación de disolución.
Calcular la fuerza iónica de una solución de cloruro de sodio (NaCl) 0.15 M y glucosa (C6H12O6) 0.3 M.
El NaCl se disocia en la forma siguiente:
NaCl → Na+ + Cl–
La glucosa, sin embargo, no se disocia en iones por tener en su estructura química solo enlaces de tipo covalente. Por lo tanto, la valencia de la glucosa (Z) es igual a cero (0). Calculamos entonces la fuerza iónica producto del NaCl:
I = 1/2 [C · (+1)1 + C · (-1)1]
= 1/2 [0.15 M · 1 + 0.15 M · 1]
= 0.15 M
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Wikipedia. (2020). Ionic strength. Recuperado de: en.wikipedia.or
- Dr. David K. Ryan. (s.f.). Activity & Ionic Strength Class 4 Ryan. [PDF]. Recuperado de: faculty.uml.edu
- University of Michigan. (s.f.). A More Detailed Look at Chemical Equilibria. [PDF]. Recuperado de: umich.edu
- Elsevier B.V. (2020). Ionic Strength. ScienceDirect. Recuperado de: sciencedirect.com
- C.D. Kennedy. (1990). Ionic Strength and the Dissociation of Acids. [PDF]. Recuperado de: iubmb.onlinelibrary.wiley.com
