Borohidruro de sodio (NaBH4): estructura, propiedades, usos
El borohidruro de sodio es un sólido inorgánico cuya fórmula química es NaBH4. Puede considerarse representativo de los borohidruros alcalinos y es el más común de estos. Es un sólido blanco cristalino.
Al entrar en contacto con agua, el NaBH4 puede generar calor e hidrógeno H2 el cual es combustible, por lo que debe de manejarse con precaución. Por la facilidad con que puede generar iones hidruro H–, el borohidruro de sodio es un compuesto moderadamente reductor, por lo que se usa ampliamente en reacciones químicas con este propósito.

Su propiedad reductora también es utilizada en la industria papelera, pues permite mejorar las características de brillo y estabilidad de la pulpa y papel al actuar en contra de la oxidación de la celulosa, componente principal del papel.
Debido a que en presencia de agua puede formar hidrógeno fácilmente, también se ha investigado la posibilidad de emplearlo como fuente reversible de hidrógeno en celdas de combustible.
Tiene otros usos todos basados en su propiedad reductora, como por ejemplo en la industria farmacéutica.
Índice del artículo
- 1 Estructura
- 2 Nomenclatura
- 3 Propiedades físicas
- 4 Propiedades químicas
- 5 Riesgos
- 6 Obtención
- 7 Usos
- 8 Referencias
El borohidruro de sodio es un compuesto iónico. Está formado por el anión borohidruro [BH4]– unido al catión sodio Na+.
El anión [BH4]– es tetraédrico.
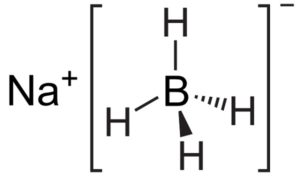
Su estructura de Lewis es la siguiente:

-Borohidruro de sodio
-Tetrahidroborato de sodio
-Tetrahidruroborato de sodio
Sólido blanco cristalino.
37,84 g/mol
∼ 220 ºC
> 250 ºC
1,074 g/cm3 a 20 ºC
El NaBH4 es bastante soluble en agua (55 g/100mL a 25 ºC), donde se hidroliza parcialmente. Es soluble en tetrahidrofurano (THF) y es insoluble en éter dietílico.
El borohidruro de sodio se disuelve en agua, donde sufre una descomposición o hidrólisis inicial que hace que la solución sea básica, lo que impide una posterior hidrólisis.
[BH4]– + H2O → B(OH)3 + H2↑ + OH–
Esto se explica porque el [BH4]– interacciona con el H+ del agua, donde el H+ toma un anión hidruro H– para formar H2. Se puede decir que el BH3 compite con el H+ por el ion hidruro H–.
En medio ácido la hidrólisis es completa debido a la abundancia de iones H+.
El NaBH4 es estable en aire seco. No es volátil.
Por su contenido de iones hidruro, el borohidruro de sodio es un compuesto reductor. Permite reducir el grupo carbonilo C=O a C-OH, es decir, compuestos carbonílicos a alcoholes.
El NaBH4 por sí solo no reduce dobles enlaces C=C, ni siquiera los conjugados con grupos carbonílicos –C=C-C(=O)-.
Sin embargo, al entrar en contacto con ácidos protónicos (como el HCl) o con ácidos de Lewis (como BCl3 o AlCl3) se forma diborano B2H6. Y si esta reacción se realiza en presencia de compuestos orgánicos con dobles enlaces C=C el diborano B2H6 realiza la hidroboración de estos.
En presencia de catalizadores apropiados y condiciones específicas el borohidruro de sodio puede reducir diversos tipos de grupos funcionales.
El calor de la reacción de hidrólisis en agua es suficiente para encender el hidrógeno que se forma en ella. Por lo que es importante tener precaución al manipularlo.
El NaBH4 es fácilmente encendido y se quema fácilmente.
La reacción de preparación típica del NaBH4 es mediante el hidruro de sodio NaH y el B(OCH3)3 a una temperatura de unos 250 ºC:
4 NaH + B(OCH3)3 → NaBH4 + 3 NaOCH3
Por ser una fuente de iones H–, el NaBH4 es un compuesto reductor y se emplea para preparar otros compuestos químicos. Para ello se usa en solventes polares apróticos, esto es, sin protones H+, como el dimetilsulfóxido, la hexametilfosforamida y la dimetilformamida.
Es usado como agente reductor en reacciones tanto de química orgánica como inorgánica.
Permite reducir aldehídos a alcoholes primarios y cetonas a alcoholes secundarios.
También reduce haluros de alquilo a hidrocarburos como por ejemplo el iododecano a decano, el ácido bromoundecanoico a ácido undecanoico y el clorododecano a dodecano.
Si actúa solo, al realizar la reducción no afecta otros grupos funcionales como éster, ácido carboxílico, nitrilo y sulfona.
Su propiedad de no reducir dobles enlaces C=C, ni siquiera los conjugados con grupos carbonílicos –C=C-C(=O)-, permite preparar alcoholes insaturados -C=C-CH2-OH.
Para reducir compuestos aromáticos nitrados a sus correspondientes anilinas requiere la presencia de catalizadores como cloruro de cobalto o estaño. Reduce disulfuros a tioles.
En presencia de condiciones y catalizadores apropiados permite reducir ácidos carboxílicos, ésteres, amidas, nitrilos, iminas, epóxidos e incluso dobles y triples enlaces.
El NaBH4 puede ser convertido en una celda de combustible.
El NaBH4 en presencia de una solución alcalina de KOH o NaOH se hidroliza y produce hidrógeno H2 el cual puede usarse como combustible en una pila de combustible de electrolito polimérico.
También ha sido investigado como material para almacenamiento de H2 de forma reversible.
Se sintetizan nanopartículas de NaBH4 y se estabilizan con un surfactante. Luego de un tratamiento con NiCl2 se forma una capa o revestimiento protector que regula la liberación de H2 de forma completamente reversible.
Este nuevo material nanométrico permitiría la utilización del H2 como combustible limpio y producido de forma renovable.

El borohidruro de sodio se emplea para mejorar el brillo y otras propiedades físicas de la pulpa y el papel.
La degradación de la matriz celulósica del papel ocurre a través de procesos complejos que involucran la oxidación. Los grupos hidroxilo se oxidan a carbonilo y carboxilo, esto conduce a la decoloración del papel y disminución de sus propiedades físicas.
Al tratar la pulpa o papel con NaBH4, este reduce aldehídos y cetonas a grupos –OH sin afectar los grupos carboxílicos ácidos, mejorando la estabilidad y el brillo a valores mayores que los iniciales.

El borohidruro de sodio se emplea para tratar aguas de desecho, como agente mejorador del sabor en la industria de alimentos y bebidas, como agente de recubrimiento y para el tratamiento de superficies, en la producción de tabaco, en la industria farmacéutica, de textiles y de cuero.
- Christian, M.L. and Aguey-Zinsou, K.-F. (2012). Core-Shell Strategy Leading to High Reversible Hydrogen Storage Capacity for NaBH4. ACS Nano 2012, 6, 9, 7739-7751. Recuperado de pubs.acs.org.
- Nora de Souza, M.V. and Alves V., T.R. (2006). Recent methodologies mediated by sodium borohydride in the reduction of different clases of compounds. App. Organometal. Chem. 2006; 20: 798-810. Recuperado de onlinelibrary.wiley.com.
- Imamoto, T. (1991). Reduction. Sodium Borohydride. In Comprehensive Organic Synthesis. Recuperado de sciencedirect.com.
- Tang, L.C. (1986) Stabilization of Paper through Sodium Borohydride Treatment. In Historic Textile and Paper Materials. Chapter 24. Pages 427-441. Advances in Chemistry, Volume 212. Recuperado de pubs.acs.org.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- Morrison, Robert Thornton; and Boyd, Robert Neilson. 1992. Organic Chemistry. Prentice-Hall. ISBN 81-203-0765-8.
- U.S. National Library of Medicine. (2019). Sodium borohydride. Recuperado de: pubchem.ncbi.nlm.nih.gov.
