Óxido de berilio: qué es, estructura química, propiedades y usos
¿Qué es el óxido de berilio?
El óxido de berilio (BeO) es un material cerámico que, además de su alta fuerza y resistividad eléctrica, presenta una capacidad de conducción de calor tan alta que hace que forme parte de reactores nucleares, superando incluso a los metales en esta última propiedad.
Además de su utilidad como material sintético, también puede ser encontrado en la naturaleza, aunque es poco común. Su manejo debe llevarse a cabo con cuidado, ya que tiene capacidad de dañar seriamente la salud de los seres humanos.
En el mundo moderno se ha observado cómo los científicos asociados con empresas tecnológicas han llevado a cabo investigaciones para desarrollar materiales avanzados para aplicaciones bastante especializadas, como aquellas que cumplen los materiales semiconductores y los de la industria aeroespacial.
El resultado de esto ha sido el descubrimiento de sustancias que, gracias a sus propiedades extremadamente útiles y su alta durabilidad, nos han brindado la oportunidad de avanzar en el tiempo, permitiéndonos llevar nuestra tecnología a mayores niveles.
Estructura química del óxido de berilio
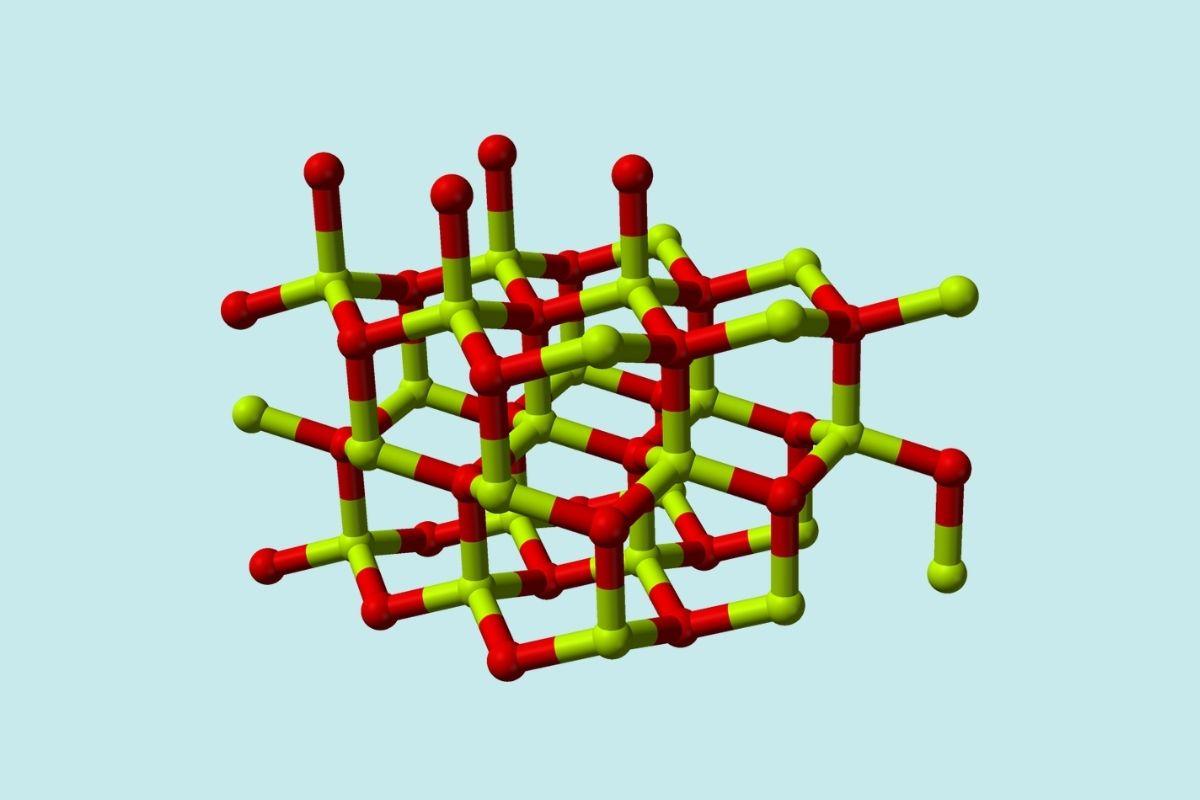
Una molécula de óxido de berilio (también llamado berilia) está conformada por un átomo de berilio y uno de oxígeno, ambos coordinados en orientación tetraédrica, y se cristaliza en estructuras cristalinas hexagonales llamadas wurtzitas.

Estos cristales poseen centros tetraédricos, los cuales están ocupados por Be2+ y O2-. A altas temperaturas, la estructura del óxido de berilio pasa a ser del tipo tetragonal.
La obtención del óxido de berilio se logra por tres métodos: la calcinación del carbonato de berilio, la deshidratación del hidróxido de berilio, o por la ignición de berilio metálico. El óxido de berilio formado a altas temperaturas es de carácter inerte, pero puede ser disuelto por varios compuestos.
BeCO3 + Calor → BeO + CO2 (Calcinación)
Be(OH)2 → BeO + H2O (Deshidratación)
2 Be + O2 → 2 BeO (Ignición)
Finalmente, el óxido de berilio puede ser vaporizado, y en este estado se presentará en forma de moléculas diatómicas.
Propiedades del óxido de berilio
El óxido de berilio se presenta en la naturaleza como bromellita, un mineral blanco que se encuentra en algunos depósitos complejos de manganeso-hierro, pero es más comúnmente encontrado en su forma sintética: un sólido amorfo de color blanco que se produce en forma de polvo.
Asimismo, las impurezas que hayan quedado atrapadas durante la producción le darán colores variados a la muestra del óxido.
Su punto de fusión se ubica en 2.507º C, su punto de ebullición en 3.900º C, y posee una densidad de 3,01 g/cm3.
Del mismo modo, su estabilidad química es considerablemente alta, únicamente reaccionando con vapor de agua a temperaturas cercanas a 1.000º C, y puede resistir procesos de reducción por carbono y ataques por metales fundidos a altas temperaturas.
Además, su resistencia mecánica es decente, y puede ser mejorada con diseños y fabricación adecuada para usos comerciales.
Conductividad eléctrica
El óxido de berilio es un material cerámico sumamente estable, y por ende tiene una resistividad eléctrica bastante alta que lo convierte en uno de los mejores materiales aislantes eléctricos, junto con la alúmina.
Debido a esto, se utiliza comúnmente para equipos eléctricos especializados de alta frecuencia.
Conductividad térmica
El óxido de berilio tiene una gran ventaja en cuanto a su conductividad térmica: es conocido como el segundo mejor material conductor de calor entre los no metales, siendo superado únicamente por el diamante, un material considerablemente más costoso y raro.
En cuanto a los metales, solamente el cobre y la plata transfieren mejor el calor por conducción que el óxido de berilio, convirtiéndolo en un material muy deseable.
Por sus excelentes propiedades conductoras de calor, esta sustancia se ha visto involucrada en la producción de materiales refractarios.
Propiedades ópticas
Por sus mismas propiedades cristalinas, el óxido de berilio es usado para la aplicación de material transparente al ultravioleta en ciertas pantallas planas y células fotovoltaicas.
Igualmente, pueden producirse cristales de muy alta calidad, por lo que estas propiedades mejoran según el proceso de manufactura utilizado.
Riesgos de salud
El óxido de berilio es un compuesto que debe ser manipulado con sumo cuidado, ya que primeramente posee propiedades carcinogénicas, las cuales se han vinculado a la inhalación continua de polvos o vapores de este material.
Las pequeñas partículas en estas fases del óxido se adhieren a los pulmones, y pueden generar la formación de tumores o de una enfermedad conocida como beriliosis.
La beriliosis es una enfermedad con una tasa de mortalidad mediana que produce respiración ineficiente, tos, pérdida de peso y fiebre, y la formación de granulomas en los pulmones u otros órganos afectados.
También existen peligros a la salud por contacto directo del óxido de berilio con la piel, ya que es corrosivo e irritante, y puede producir daño en la superficie cutánea y las mucosas. Se deben proteger las vías respiratorias y las manos al trabajar con este material, especialmente en su forma de polvo.
Usos del óxido de berilio
Los usos del óxido de berilio se dividen principalmente en tres: las aplicaciones electrónicas, las nucleares y otras.
Aplicaciones electrónicas
La habilidad de transferir calor a un alto nivel y su buena resistividad eléctrica han hecho que el óxido de berilio adquiera una utilidad grande como disipador térmico.
Se ha evidenciado su uso en los circuitos dentro de computadoras de alta capacidad, además de equipos que manejan altas corrientes de electricidad.
El óxido de berilio es transparente para rayos X y microondas, por lo que se utiliza en las ventanas contra estos tipos de radiación, además de antenas, sistemas de comunicación y hornos microondas.
Aplicaciones nucleares
Su capacidad de moderar los neutrones y mantener su estructura bajo bombardeos de radiación ha hecho que el óxido de berilio se vea involucrado en la construcción de reactores nucleares, pudiendo también aplicarse en los reactores de alta temperatura enfriados por gases.
Otras aplicaciones
La baja densidad del óxido de berilio ha generado interés en las industrias de tecnología aeroespacial y militar, ya que puede representar una opción de bajo peso en los motores para cohetes y chalecos antibalas.
Finalmente, se ha visto aplicado recientemente como material refractario en la fusión de metales en industrias metalúrgicas.
Referencias
- PubChem (s.f.). Beryllium Oxide. Obtenido de pubchem.ncbi.nlm.nih.gov
- Reade (s.f.). Beryllia/Beryllium Oxide (BeO). Recuperado de reade.com
- Research, C. (s.f.). Beryllium Oxide – Beryllia. Obtenido de azom.com
- Services, N. J. (s.f.). Beryllium Oxide. Recuperado de nj.gov
- Wikipedia (s.f.). Beryllium Oxide. Obtenido de en.wikipedia.org
