Anafilotoxinas: tipos, funciones y receptores
Las anafilotoxinas son fragmentos peptídicos de bajo peso molecular que se generan por la activación del sistema del complemento. Son altamente hidrofílicas, con una estructura en alfa hélice unida por 3 puentes disulfuro.
Se activan proteolíticamente por ruptura en un sitio específico, formando fragmentos a y b. Estos péptidos se unen a receptores específicos expresados en la superficie de las células y amplifican una variedad de reacciones inflamatorias, actuando como activadores celulares.
Sus funciones efectoras incluyen quimiotaxis, liberación de mediadores inflamatorios y activación de granulocitos, mastocitos y macrófagos. Recientemente también se ha evidenciado que las anafilotoxinas se generan localmente dentro de los tejidos por la presencia de patógenos.
Índice del artículo
- 1 Tipos
- 2 Funciones
- 3 Asociación de C5a y C3a con patogénesis
- 4 Receptores
- 5 Sistemas de complemento en vertebrados inferiores
- 6 Referencias
Las anafilotoxinas incluyen los péptidos C3a, C5a y C4a. Estos son fragmentos de escisión de baja masa molecular (∼10 kDa) de la cadena α de los componentes del complemento C3, C4 y C5, respectivamente, que se liberan durante la activación del complemento.
Sin embargo, hay que destacar que para C4a, solo se ha demostrado que se une a su receptor con baja afinidad y no se ha identificado ningún receptor específico del mismo.
Por su parte, C5a es el más potente de estos péptidos, es decir que promueve la inflamación y es un fuerte quimio atrayente para neutrófilos, macrófagos y monocitos.
Aunque los vertebrados inferiores poseen sistemas de complemento que se cree que funcionan de manera similar a los de los mamíferos, los receptores de anafilatoxinas no se han caracterizado previamente en ningún vertebrado no mamífero.
Las anafilotoxinas se generan de la escisión enzimática durante el curso de activación del complemento a través de las vías clásicas, de lectinas o alternativa.
En la cascada de activación del complemento, la escisión de C3 o C5 por las convertasas C3 o C5 conduce a la generación de un gran fragmento, C3b o C5b y un pequeño fragmento de péptido, C3a o C5a.
C3b y C5b continúan la cascada de activación del complemento en las superficies microbianas o celulares, mientras que C3a y C5a se liberan en la fase fluida para actuar como anafilotoxinas, las cuales median diversas acciones biológicas.
Aumentan la permeabilidad vascular, estimulando las contracciones del músculo liso e induciendo la liberación de histamina de los mastocitos y los gránulos secretores de los granulocitos y macrófagos.
Además C5a, uno de los péptidos más potentes, es un poderoso quimioatrayente para neutrófilos y otros leucocitos.
Aún no se han atribuido propiedades quimioatrayentes a C4a, mientras que las de C3a parecen apuntar principalmente a eosinófilos, mastocitos y células madre hemopoyéticas la contracción del músculo liso, aumento de la permeabilidad de los capilares sanguíneos e incluso shock anafiláctico.
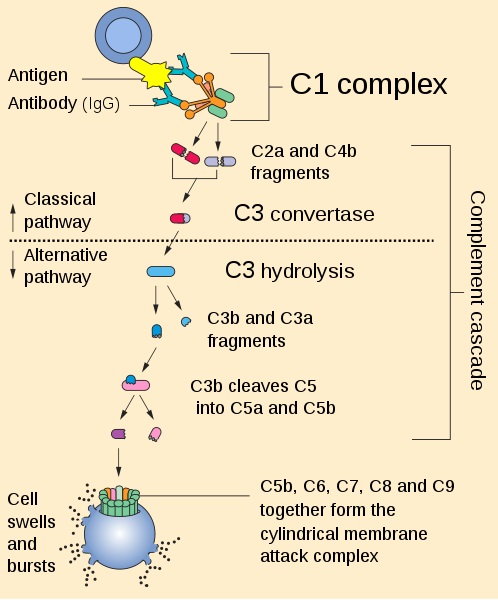
Aunque la inflamación mediada por C5a y C3a juega un papel importante en el control de la infección, una serie de estudios clínicos han demostrado que también están asociados con la patogénesis de varias enfermedades inflamatorias y autoinmunes como la sepsis, el lupus eritematoso sistémico (LES), la pérdida del embarazo, síndrome de anticuerpos antifosfolípidos (SAFL), isquemia y asma.
De este modo, se ha sugerido que atacar los receptores y/o los ligandos de C5a y C3a podría reducir las respuestas inflamatorias no deseadas, así como daño tisular en ciertas condiciones patológicas. C5a y C3a pueden ser eficientes blancos terapéuticos.
En general, las anafilotoxinas ejercen la mayoría de las actividades biológicas a través de la unión de tres receptores afines, es decir; el receptor C3a, el receptor C5a y el receptor tipo C5a, C5L2.
En humanos, se han identificado tres tipos de receptores transmembrana que median las acciones de las anafilotoxinas: el C3aR, que se une específicamente a C3a; el C5aR, que se une a C5a; y el C5L2, para el cual las tres anafilotoxinas pueden ser ligandos.
Los dos primeros receptores se acoplan a las proteínas G reguladoras, mientras que se ha demostrado que el receptor C5L2 se acopla mal a las vías de señalización mediadas por la proteína G.
La distribución de estos receptores no se limita a los leucocitos. También se expresan en muchos tipos de células no mieloides, incluidos los hepatocitos, las células epiteliales pulmonares, las células endoteliales, los astrocitos cerebrales y las células microgliales.
En estos tipos de células, pueden mediar la participación de las anafilotoxinas en varias afecciones neurológicas vasculares, pulmonares, regenerativas y degenerativas.
Si las anafilotoxinas no se unen a sus receptores, estas se digieren rápidamente mediante carboxipeptidasas plasmáticas, que eliminan el residuo de arginina C-terminal de cada péptido.
Los derivados de arginina están inactivos o tienen actividades 10 a 1000 veces más bajas que las de los péptidos nativos.
Los vertebrados inferiores, como los reptiles, los anfibios y los peces, poseen sistemas de complemento que, en muchos sentidos, se consideran funcionalmente similares a los de los mamíferos.
Se han demostrado respuestas inmunitarias protectoras mediadas por el complemento, como la citólisis y la opsonización, en algunos de estos animales.
Recientemente, se ha demostrado que el C3a del tunicado Ciona intestinalis posee actividades quimiotácticas para los hemocitos de tunicado, lo que sugiere la presencia de un receptor C3aR en estos animales.
Los protocordados por su parte, pueden no poseer C4a y C5a, por lo que se cree que la ruta clásica de activación del complemento, que produce C4a y la ruta lítica, que genera C5a están ausentes en estos animales.
Sin embargo, los peces gnatóstomos poseen todas las vías de activación del complemento conocidas, y se han identificado las moléculas C3, C4 y C5 de varias especies de peces. Curiosamente, los peces tienen múltiples isoformas de varios de los componentes del complemento, incluidos C3, C2 / Bf, C4 y C5.
Aunque se han sugerido diferentes funciones para las isoformas C3, queda por establecer si existen diferentes receptores para estas isoformas.
- De Yang. Anaphylatoxins. Handbook of Biologically Active Peptides.pp.625-630 http://dx.doi.org/10.1016/B978-0-12-385095-9.00085-3
- Gennaro R, Simonic T, Negri A, Mottola C, Secchi C, Ronchi S, Romeo D. C5a fragment of bovine complement. Purification, bioassays, amino-acid sequence and other structural studies. European Journal of Biochemistry. 1986; 155(1):77-86.
- Holland CH, Lambris JD. Functional C5a Anaphylatoxin Receptor in a Teleost Species. The Journal of Immunology. 2004; 172(1):349-355.
- Klos A, Tenner AJ, Johswich K, Ager R, Reis ES, Köhlc J. The Role of the Anaphylatoxins in Health and Disease. Molecular immunology. 2009; 46(14):2753-2766.
- Ogata RT, Rosa PA, Zepf NE. Sequence of the gene for murine complement component C4. The Journal of Biological Chemistry. 1989, 264(28):16565-16572.
- Peng Q, Li K, Sacks SH, Zhou W. The role of anaphylatoxins C3a and C5a in regulating innate and adaptive immune responses. Inflammation & Allergy Drug Targets. 2009; 8(3):236-246.
