Escala microscópica: propiedades, contar partículas, ejemplos
La escala microscópica es aquella que se utiliza para medir los tamaños y longitudes que no pueden apreciarse a simple vista y que están por debajo del milímetro de longitud. De mayor a menor, las escalas microscópicas en el sistema métrico son:
– El milímetro (1 mm), que es la décima parte de un centímetro o la milésima parte de un metro. En esta es la escala tenemos a una de las células más grande del organismo, que es el óvulo, cuyo tamaño es de 1,5mm.
– La décima de milímetro (0,1 mm). Esta es la escala del grosor o diámetro de un cabello humano.
– El micrómetro o micra (1μm = 0,001mm). En esta escala están las células vegetales y animales y las bacterias.
Las células vegetales son del orden de 100μm. Las células animales son diez veces menores, es del orden de 10μm; mientras que las bacterias son 10 veces menores que las células animales y son del orden de 1μm.
Índice del artículo
- 1 Escala nanométrica
- 2 Instrumentos para la observación microscópica
- 3 Propiedades microscópicas
- 4 ¿Cómo contar partículas en escala microscópica?
- 5 Referencias
Existen medidas aún más pequeñas que la escala microscópica, pero que no se utilizan habitualmente salvo en algunos contextos especiales. A continuación veremos algunas de las medidas nanométricas más importantes:
– El nanómetro (1 ηm = 0,001 μm = 0,000001 mm) es la millonésima parte de un milímetro. En esta escala están algunos virus y moléculas. Los virus son del orden de los 10ηm y las moléculas del orden de 1ηm.
– El angstrom (1Å = 0,1ηm = 0,0001μm = 10-7mm). Esta medida forma la escala o tamaño atómico.
– El fantómetro (1fm = 0,00001Å = 0,000001ηm = 10-12mm). Esta es la escala de los núcleos atómicos, los cuales son entre 10 mil y 100 mil veces más pequeños que el átomo. Sin embargo, a pesar de su pequeño tamaño, el núcleo concentra el 99,99% de la masa atómica.
– Hay escalas menores al núcleo atómico, pues estos están constituidos por partículas como lo son los protones y los neutrones. Pero hay más: estas partículas están a su vez están constituidas por partículas más fundamentales como lo son los quarks.
Cuando los objetos están entre las escala milimétrica y la micrométrica (1 mm – 0,001mm), pueden ser observados con un microscopio óptico.
Sin embargo, si los objetos u estructuras están entre los nanómetros y los Angstrom, entonces se requerirá de microscopios electrónicos o del nanoscopio.
En la microscopía electrónica en vez de luz se usan electrones de alta energía que tienen una longitud de onda mucho menor que la luz. La desventaja del microscopio electrónico es que no es posible colocar en él muestras vivas porque trabaja al vacío.
En cambio, en el nanoscopio se usa luz láser, y tiene la ventaja sobre la microscopía electrónica de que se pueden mirar y grabar las estructuras y moléculas dentro de una célula viva.
La nanotecnología es la tecnología con la que se fabrican circuitos, estructuras, piezas y hasta motores en las escalas que van desde el nanómetro hasta la escala atómica.
En física, en una primera aproximación se estudia el comportamiento de la materia y los sistemas desde el punto de vista macroscópico. Desde este paradigma la materia es un continuo infinitamente divisible; y este punto de vista es válido y adecuado para muchas situaciones de la vida cotidiana.
Sin embargo, algunos fenómenos del mundo macroscópico solo tienen explicación si se tienen en cuenta las propiedades microscópicas de la materia.
En el punto de vista microscópico se tiene en cuenta la estructura molecular y atómica de la materia. A diferencia de la aproximación macroscópica, en esta escala hay una estructura granular con huecos y espacios entre las moléculas, los átomos e incluso dentro de estos.
La otra característica del punto de vista microscópico en física, es que un trozo de materia por pequeño que sea, está compuesto de un enorme número de partículas separadas entre sí y en continuo movimiento.
En un pequeño trozo de materia la distancia entre átomos es enorme si se compara con el tamaño de los mismos, pero a su vez los átomos son enormes si se comparan con sus propios núcleos, donde está concentrada el 99,99% de la masa.
Es decir, un trozo de materia en la escala microscópica es un enorme vacío con concentraciones de átomos y núcleos que ocupan una pequeñísima fracción del volumen total. En este sentido la escala microscópica tiene similitud con la escala astronómica.
De los objetos macroscópicos al descubrimiento del átomo
Los primeros químicos, que fueron los alquimistas, se dieron cuenta de que los materiales podían ser de dos tipos: puros o compuestos. Así se llegó a la idea de los elementos químicos.
Los primeros elementos químicos descubiertos fueron los siete metales de la antigüedad: plata, oro, hierro, plomo, estaño, cobre y mercurio. Con el tiempo se fueron descubriendo más en la medida en que se encontraban sustancias que no podían descomponerse en otras.
Luego los elementos se clasificaron según sus propiedades y características en metales y no metales. Todos aquellos que tenían propiedades y afinidad química semejante se agruparon en una misma columna, y así surgió la tabla periódica de los elementos.
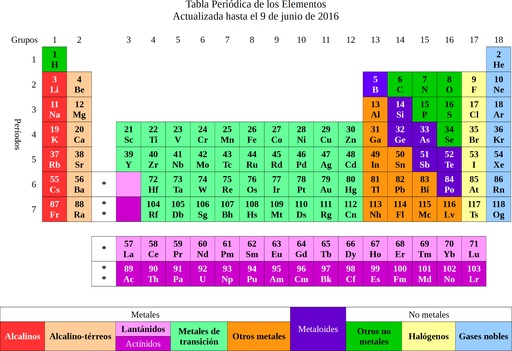
De los elementos se pasó a la idea de los átomos, palabra que significa indivisible. Poco tiempo después los científicos se percataron de que los átomos sí tenían una estructura. Además los átomos tenían dos tipos de carga eléctrica (positiva y negativa).
Partículas subatómicas
En los experimentos de Rutherford en los que bombardeó los átomos de una delgada placa de oro con partículas alfa, se puso de manifiesto la estructura del átomo: un pequeño núcleo positivo rodeado de electrones.
Se siguieron bombardeando los átomos cada vez con partículas de más energía y todavía se sigue haciendo, con el fin de desentrañar los secretos y propiedades del mundo microscópico cada vez a menor escala.
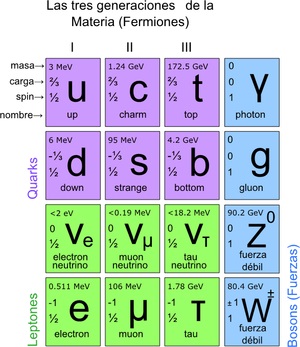
De esta forma se llegó al modelo estándar, en el que se establece que las verdaderas partículas elementales, son aquellas de las que se componen los átomos. A su vez, los átomos dan lugar a los elementos, estos a los compuestos y a todas las interacciones conocidas (excepto la gravitación). En total son 12 partículas.
Estas partículas fundamentales también tienen su tabla periódica. Hay dos grupos: las partículas fermiónicas de espín ½ y las bosónicas. Las bosónicas son responsables de las interacciones. Las fermiónicas son 12 y son las que dan lugar a los protones, neutrones y a los átomos.
Con el tiempo los químicos fueron descubriendo las masas relativas de los elementos a partir de mediciones precisas en las reacciones químicas. Así por ejemplo pudo determinarse que el carbono es 12 veces más pesado que el hidrógeno.
También se determinó que el hidrógeno es el elemento más liviano, de modo que a este elemento se le asignó la masa relativa 1.
Por otra parte los químicos requerían saber el número de partículas que intervienen en una reacción, de modo que ni sobre ni falte ningún reactivo. Por ejemplo una molécula de agua requiere dos átomos de hidrógeno y uno de oxígeno.
De estos antecedentes nace el concepto de mol. Un mol de cualquier sustancia es una cantidad fija de partículas equivalente a su masa molecular o atómica en gramos. Así se determinó que 12 gramos de carbono tienen el mismo número de partículas que 1 gramo de hidrógeno. Ese número se conoce como el número de Avogadro: 6,02 x 10^23 partículas.
Calcule cuántos átomos de oro hay en 1 gramo de oro.
Solución
Se sabe que el oro tiene un peso atómico de 197. Este dato puede encontrarse en la tabla periódica e indica que un átomo de oro es 197 veces más pesado que uno de hidrógeno y 197/12= 16,416 veces más pesado que el carbono.
Un mol de oro tiene 6,02×10^23 átomos y tiene el peso atómico expresado en gramos, es decir, 197 gramos.
En un gramo de oro hay 1/197 moles de oro, es decir 6,02×10^23átomos/197 = 3,06 x10^23 átomos de oro.
Determine el número de moléculas de carbonato de calcio (CaCO3) que hay en 150 gramos de esta sustancia. Diga también cuantos átomos de calcio, cuántos de carbono y cuántos de oxígeno hay en este compuesto.
Solución
Lo primero es determinar la masa molecular del carbonato de calcio. La tabla periódica indica que el calcio tiene un peso molecular de 40 g/mol, el carbono 12 g/mol y el oxígeno 16 g/mol.
Entonces la masa molecular de (CaCO3) será :
40 g/mol + 12 g/mol + 3 x 16 g/mol = 100 g/mol
Cada 100 gramos de carbonato de calcio son 1mol. Entonces en 150 gramos corresponden a 1,5 moles.
Cada mol de carbonato tiene 6,02 x 10^23 moléculas de carbonato, por lo que en 1,5 moles de carbonato hay 9,03 x 10^23 moléculas.
Resumiendo, en 150 gramos de carbonato de calcio hay:
– 9,03 x 10^23 moléculas de carbonato de calcio.
– Átomos de calcio: 9,03 x 10^23 .
– También 9,03 x 10^23 átomos de carbono
– Por último, 3 x 9,03 x 10^23 átomos de oxígeno = 27,09 x 10^23 átomos de oxígeno.
- Biología aplicada. ¿Cuáles son las medidas microscópicas?. Recuperado de: youtube.com
- Educación Química. Representaciones macroscópicas, submicroscópicas y simbólicas sobre la materia. Recuperado de: scielo.org.mx.
- García A. Curso interactivo de física. Macroestados, microestados. Temperatura, Entropía. Recuperado de: sc.ehu.es
- La estructura microscópica de la materia. Recuperado de: alipso.com
- Wikipedia. Nivel Microscópico. Recuperado de: wikipedia.com
