Ácido fórmico (HCOOH): estructura, propiedades, usos, y reacciones
¿Qué es el ácido fórmico?
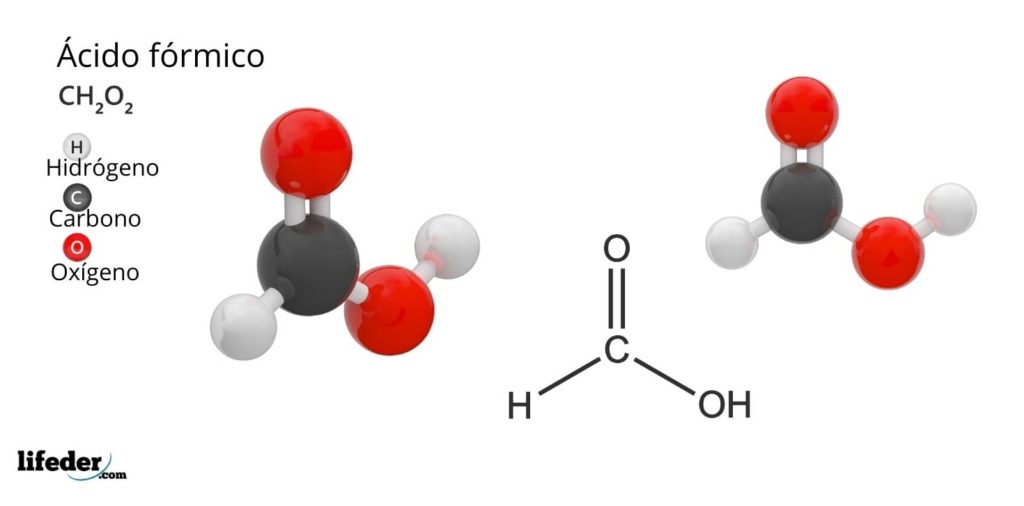
El ácido fórmico o ácido metanoico es el compuesto más simple y pequeño de todos los ácidos orgánicos. Es conocido también como ácido metanoico y su fórmula molecular es HCOOH, teniendo apenas un átomo de hidrógeno enlazado al átomo de carbono. Su nombre deriva de la palabra formica, que en latín significa hormiga.
Los naturalistas del siglo XV encontraron que cierto tipo de insectos (los formícidos), como las hormigas, termitas, abejas y escarabajos, secretan este compuesto responsable de sus dolorosas picadas. Asimismo, estos insectos emplean el ácido fórmico como mecanismo de ataque, defensa y señalización química.
Poseen glándulas venenosas que excretan a este y otros ácidos (por ejemplo, el ácido acético) como un rocío hacia el exterior. El ácido fórmico es más fuerte que el ácido acético (CH3COOH); por lo tanto, disueltos en iguales cantidades en agua, el ácido fórmico produce soluciones con valores de pH más bajos.
El naturalista inglés John Ray logró el aislamiento del ácido fórmico en el año 1671, destilándolo a partir de grandes cantidades de hormigas.
Por otro lado, la primera síntesis exitosa de este compuesto fue realizada por el químico y físico francés Joseph Gay-Lussac, utilizando ácido cianhídrico (HCN) como reactivo.
¿Dónde se encuentra el ácido fórmico?

El ácido fórmico puede estar presente a niveles terrestres, como componente de la biomasa o en la atmósfera, involucrado en un amplio espectro de reacciones químicas; incluso puede encontrarse bajo los suelos, dentro del petróleo o en fase gaseosa sobre su superficie.
En términos de biomasa, los insectos y las plantas son los principales generadores de este ácido. Cuando los combustibles fósiles son quemados producen ácido fórmico gaseoso; en consecuencia, los motores de los vehículos liberan ácido fórmico a la atmósfera.
Sin embargo, la Tierra hospeda un número exorbitante de hormigas, y entre todas estas son capaces de producir en un año miles de veces la cantidad de ácido fórmico generada por la industria humana. Asimismo, los incendios forestales representan fuentes gaseosas del ácido fórmico.
Más arriba, en la compleja matriz atmosférica, ocurren procesos fotoquímicos que sintetizan ácido fórmico.
A estas alturas muchos compuestos orgánicos volátiles (VOCs, por sus siglas en inglés) son degradados bajo los efectos de la radiación ultravioleta, o son oxidados por mecanismos de radicales libres OH. La rica y compleja química atmosférica es, por mucho, la fuente predominante de ácido fórmico del planeta.
Estructura del ácido fórmico
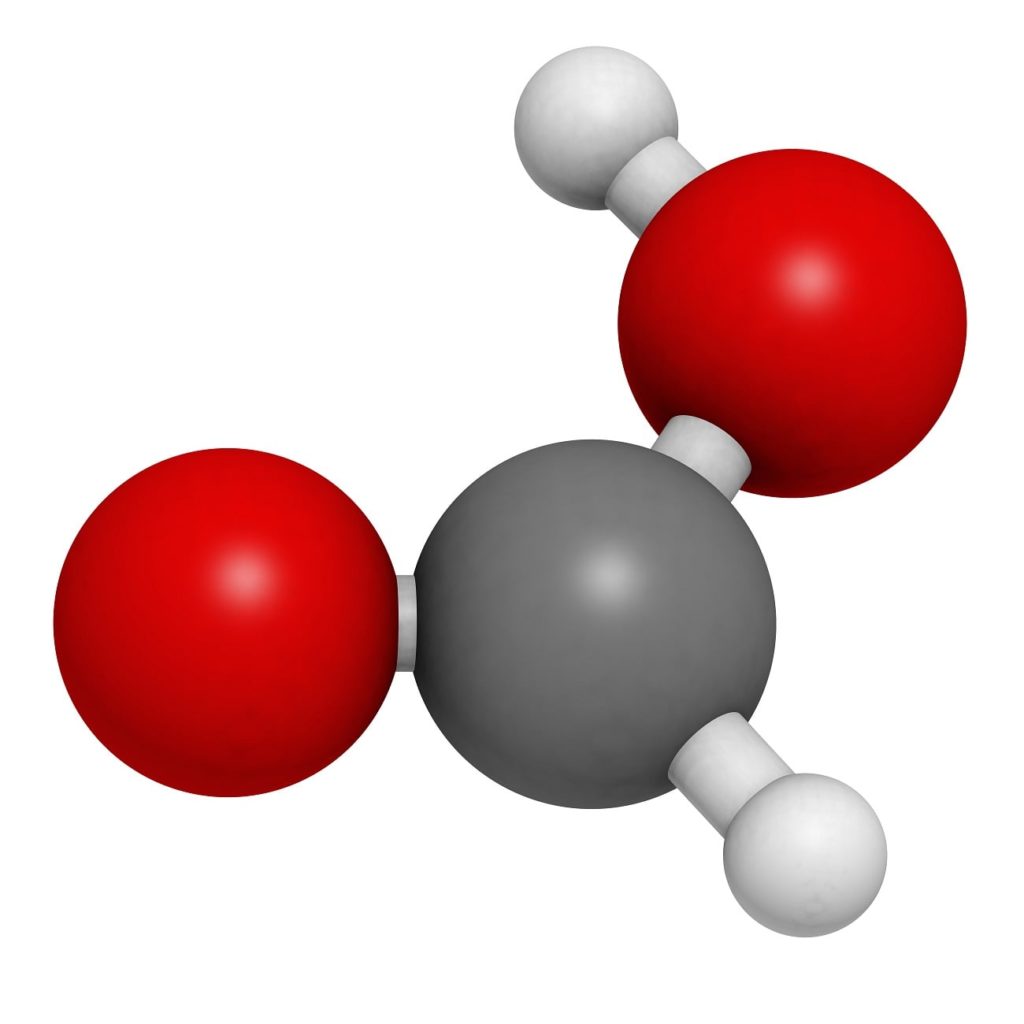
En la imagen superior está ilustrada la estructura de un dímero en fase gaseosa de ácido fórmico. Las esferas blancas corresponden a los átomos de hidrógeno, las rojas a los átomos de oxígeno y las negras a los átomos de carbono.
En estas moléculas pueden apreciarse dos grupos: el hidroxilo (–OH) y el formilo (–CH=O), ambos capaces de formar puentes de hidrógeno.
Estas interacciones son del tipo O–H—O, siendo los grupos hidroxilos los donadores de los H y los grupos formilo los donadores de los O.
Sin embargo, el H enlazado al átomo de carbono carece de esta capacidad. Estas interacciones son muy fuertes y, debido al átomo de H pobre en electrones, el hidrógeno del grupo OH es más ácido; por lo tanto, este hidrógeno estabiliza aún más los puentes.
Como resultado de lo anterior, el ácido fórmico existe en forma de dímero y no como molécula individual.
Estructura cristalina
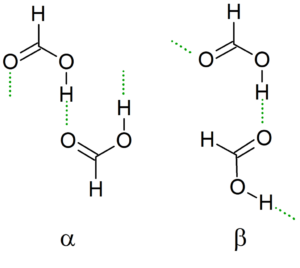
A medida que desciende la temperatura, el dímero orienta sus puentes de hidrógeno para generar la estructura más estable posible junto con los otros dímeros, creando así cadenas infinitas α y β de ácido fórmico.
Otra nomenclatura son los confórmeros “cis” y “trans”. En este caso, “cis” se utiliza para designar grupos orientados en la misma dirección, y “trans” para aquellos grupos en direcciones contrarias.
Por ejemplo, en la cadena α los grupos formilos “apuntan” hacia el mismo lado (el izquierdo), en contraste con la cadena β, donde estos grupos formilos apuntan a lados opuestos (imagen superior).
Dicha estructura cristalina depende de las variables físicas que actúan sobre esta, como la presión y la temperatura. Así, las cadenas son convertibles; es decir, en distintas condiciones una cadena “cis” puede transformarse en una cadena “trans”, y viceversa.
Si las presiones aumentan hasta niveles drásticos, las cadenas se comprimen lo suficiente como para considerarse un polímero cristalino de ácido fórmico.
Propiedades del ácido fórmico
A continuación se mencionan las propiedades físicas y químicas del ácido fórmico:
- El ácido fórmico es un líquido a temperatura ambiente, incoloro y con un olor fuerte y penetrante. Tiene un peso molecular de 46g/mol, funde a los 8,4 ºC y tiene un punto de ebullición de 100,8 ºC, mayor que el del agua.
- Es miscible en agua y en solventes orgánicos polares, como el éter, la acetona, el metanol y el etanol.
- En cambio, en los solventes aromáticos (como benceno y tolueno) es ligeramente soluble, debido a que el ácido fórmico apenas posee en su estructura un átomo de carbono.
- Tiene un pKa de 3,77, más ácido que el del ácido acético, lo cual puede explicarse porque el grupo metil aporta densidad electrónica al átomo de carbono oxidado por los dos oxígenos. Esto trae como consecuencia un leve descenso en la acidez del protón (CH3COOH, HCOOH).
- Desprotonado el ácido, este se convierte en el anión formato HCOO–, el cual puede deslocalizar la carga negativa entre los dos átomos de oxígeno. Por consiguiente, es un anión estable y explica la gran acidez del ácido fórmico.
Reacciones
El ácido fórmico puede deshidratarse en monóxido de carbono (CO) y agua. En presencia de catalizadores de platino, también puede descomponerse en hidrógeno molecular y dióxido de carbono:
HCOOH(l) → H2(g) + CO2(g)
Esta propiedad permite que el ácido fórmico sea considerado como un modo seguro de almacenar hidrógeno.
Usos/aplicaciones del ácido fórmico
La industria de los alimentos y agricultura
A pesar de lo dañino que puede ser el ácido fórmico, se utiliza a concentraciones adecuadas como preservativo en los alimentos debido a su acción antibacteriana. Por la misma razón se utiliza en la agricultura, donde además tiene una acción pesticida.
También presenta acción preservativa sobre los pastos, lo cual ayuda a prevenir los gases intestinales en los animales de cría.
La industria textil y del calzado
Se usa en la industria textil en la tinción y refinamiento de los textiles, siendo quizás el uso más frecuente de este ácido.
El ácido fórmico se utiliza en el procesamiento del cuero debido a su acción desgrasante y en la eliminación pilosa de este material.
La seguridad vial en las carreteras
Además de los usos industriales señalados, los derivados del ácido fórmico (formatos) se usan en Suiza y Austria sobre las carreteras durante el invierno, con el fin de disminuir el riesgo de accidentes. Este tratamiento es más eficiente que el uso de la sal común.
Referencias
- Tellus (1988). Atmospheric formic acid from formicine ants: a preliminary assessment408, 335-339.
- B. Millet et al. (2015). Sources and sinks of atmospheric formic acid. Atmos. Chem. Phys., 15, 6283–6304.
- Wikipedia. (2018). Formic acid. Recuperado de en.wikipedia.org
- Acipedia. Formic Acid. Recuperado de acipedia.org
- Dr. N. K. Patel. Module: 2, Lecture: 7. Formic acid. Recuperado de nptel.ac.in
- Jean and Fred. (14 de junio de 2017). Termites leaving the mounds. [Figura]. Recuperado de: flickr.com
