Concentración química: qué es, características, para qué sirve, tipos

¿Qué es la concentración química?
La concentración química es una propiedad de las soluciones que representa la cantidad de soluto que hay por cada unidad de solución. En otras palabras, es un número que indica la proporción en la que se encuentran el soluto y el solvente.
Recordemos que una solución es una mezcla homogénea formada por un solvente (generalmente líquido) y una o más sustancias disueltas en el solvente a las cuales denominamos solutos. Las soluciones están caracterizadas por el solvente, el soluto y la concentración.
La concentración es una propiedad de las soluciones muy útil, ya que nos permite describirlas. Por ejemplo, si sabemos que la concentración de la sal en el agua de mar es de 35 gramos por cada litro, entonces sabemos que, si en nuestra casa disolvemos 35 gramos de sal en un litro de solución, obtendremos una solución igual de salada que el agua de mar.
Características de la concentración química
Es una propiedad intensiva
Esta es la principal característica de la concentración. Intensiva quiere decir que no depende de la cantidad de solución que tengamos. A manera de ejemplo, esto significa que la concentración es la misma en una gota de agua de mar que en 100 litros de la misma.
Puede variar con la temperatura
En general, los líquidos se expanden o aumentan su volumen al calentarse. Esto también es cierto para las soluciones. Por esta razón, las concentraciones expresadas en función del volumen pueden cambiar levemente al calentar o enfriar la solución.
Puede abarcar rangos de valores muy amplios
Independientemente de las unidades en las que se exprese una concentración química, esta puede tener desde valores relativamente grandes, hasta valores extremadamente pequeños.
Por ejemplo, la concentración de una solución expresada en porcentaje puede tener valores desde 0% a 100%, abarcando así muchos órdenes de magnitud. Podríamos preparar una solución al 90%, como también podríamos preparar una al 10-12%, que es casi 14 órdenes de magnitud menor.
¿Para qué sirve la concentración química?
Conocer la concentración de una solución nos permite describirla. Hay muchas propiedades de las soluciones que dependen de su concentración. Por ejemplo, el punto de fusión y ebullición dependen de la concentración, por lo que conocerla nos permite calcular estas dos propiedades.
Por otro lado, la concentración nos permite comparar fácilmente una disolución con otra. Si tenemos dos soluciones de agua con azúcar, conocer sus concentraciones nos permitirá saber cuál de las dos es más dulce.
Adicionalmente, todas las reacciones químicas que hacen posible la vida dependen fuertemente de la concentración de un sinfín de solutos en las células y los alrededores de los seres vivos.
Por ejemplo, la concentración de oxígeno en el aire determina si una persona se asfixiará o no; el pH de una solución (que es una manera de medir la concentración de iones H+) determina si una bacteria vivirá y se reproducirá o si, por el contrario, morirá; y la concentración de un veneno determinará si será letal o no.
Tipos de unidades concentración
La concentración de una solución es una sola, por lo que no es correcto hablar de tipos de concentración. Sin embargo, la misma concentración se puede expresar en diferentes tipos de unidades de concentración. Estas son:
- Unidades físicas de concentración
- Unidades químicas de concentración
Unidades físicas de concentración
Estas se caracterizan por expresar las cantidades del soluto y del solvente bien sea en unidades de masa o de volumen. Se denominan unidades físicas, ya que se asocian a masas y volúmenes en lugar de moles y equivalentes.
Cuando comparamos dos soluciones que tienen la misma concentración física, no podemos asegurar que posean cantidades iguales de átomos y moléculas. Esto es lo que las distingue de las unidades de concentración química.
Las unidades físicas de concentración más comunes son:
- Título Simple (TS)
- % peso/peso (%p/p) o masa/masa (%m/m)
- % peso/volumen (%p/V) o masa/volumen (%m/V)
- % volumen/volumen (%V/V)
- Partes por millón peso/peso (ppmp/p) o masa/masa (ppmm/m)
- Partes por millón peso/volumen (ppmp/V) o masa/volumen (ppmm/V)
- Partes por millón volumen/volumen (ppmV/V)
Unidades químicas de concentración
En el caso de las unidades químicas, la cantidad de soluto y, en algunos casos, la del solvente o la solución, se expresan en términos del número de partículas o de los moles o equivalentes presentes en la solución.
Se denominan unidades químicas, ya que dos soluciones que tengan la misma concentración química sí poseen cantidades equivalentes de átomos, moléculas o iones de soluto por unidad de solución, según sea el caso.
Las unidades de concentración química más comunes son:
- Molaridad (M)
- Molalidad (m)
- Fracción molar (X)
- Normalidad (N)
Fórmula de las unidades físicas de concentración
Título Simple (TS)
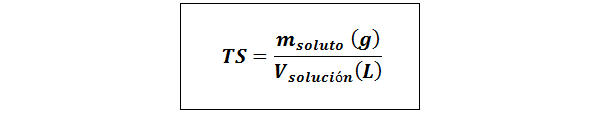
Donde msoluto representa la masa del soluto en gramos y Vsolución es el volumen de la solución en litros.
% peso/peso (%p/p) o masa/masa (%m/m)
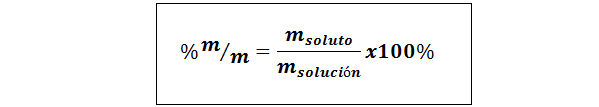
Donde msoluto y msolución representan respectivamente la masa del soluto y de la solución. Se puede emplear cualquier unidad de masa (g, mg, kg, etc.), siempre y cuando ambas masas se expresen en la misma unidad.
% peso/volumen (%p/V) o masa/volumen (%m/V)
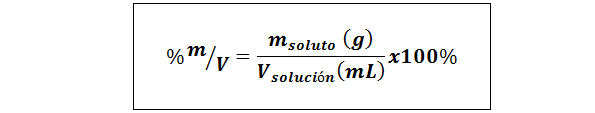
Donde msoluto es la masa de la solución en gramos y Vsolución es el volumen de la solución, en este caso en mililitros.
% volumen/volumen (%V/V)

Donde Vsoluto y Vsolución representan respectivamente el volumen del soluto y de la solución. En este caso, se puede utilizar cualquier unidad para expresar estos volúmenes, siempre y cuando sea la misma para ambos.
Partes por millón peso/peso (ppmp/p) o masa/masa (ppmm/m)
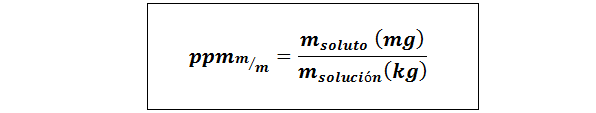
Donde msoluto y msolución representan la masa del soluto y de la solución en miligramos y kilogramos respectivamente.
Partes por millón peso/volumen (ppmp/V) o masa/volumen (ppmm/V)
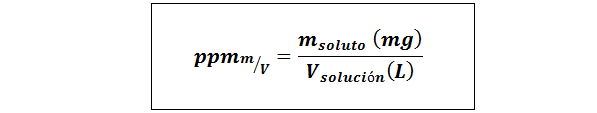
Donde msoluto es la masa de la solución en miligramos y Vsolución es el volumen de la solución, en este caso en litros.
Partes por millón volumen/volumen (ppmV/V)
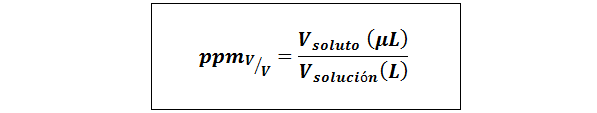
Donde Vsoluto y Vsolución son el volumen del soluto y de la solución en microlitros y litros, respectivamente.
Fórmulas de las unidades químicas de concentración
En el caso de las unidades químicas de concentración, la cantidad de los componentes de la solución, en particular del soluto, se expresa bien sea en número de moles o en número de equivalentes. Estas cantidades cuentan el número real de partículas (átomos, moléculas o iones, según sea el caso).
Estas cantidades no se pueden conocer simplemente pesando o midiendo el volumen de las sustancias, sino que es necesario conocer la composición o la fórmula química de los compuestos para poder determinar la concentración. Esta es la principal razón por la que se denominan concentraciones químicas.
A continuación, se presentan las distintas fórmulas para calcular las cuatro concentraciones químicas más comúnmente utilizadas:
Molaridad (M)
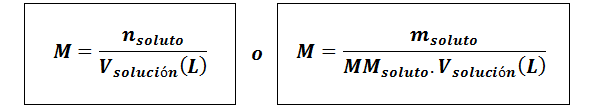
Donde nsoluto son los moles de soluto, msoluto representa la masa del soluto en gramos, MMsoluto es su masa molar y Vsolución es el volumen de la solución en litros.
Molalidad (m)
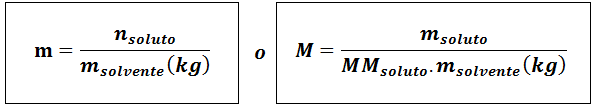
Donde nsoluto son los moles de soluto, msoluto representa la masa del soluto en gramos, MMsoluto es su masa molar y msolvente es la masa del solvente en kilogramos.
Fracción molar (X)
La fracción molar se puede calcular tanto para el soluto como para el solvente. La fracción molar del soluto es:
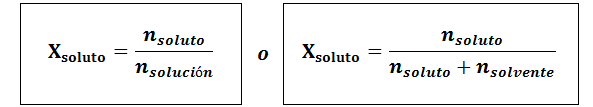
La del solvente es:
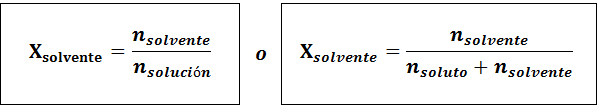
La relación entre ambas fracciones molares es:
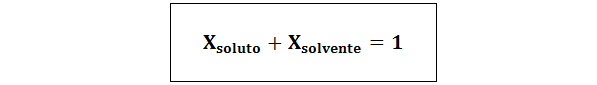
En todos los casos nsoluto, nsolución y nsolvente son los moles de soluto, solución y solvente respectivamente.
Normalidad (N)
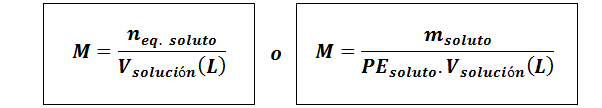
Aquí neq. soluto representa el número de equivalentes del soluto, msoluto representa la masa del soluto, PEsoluto es el peso equivalente del soluto y Vsolución es el volumen de la solución en litros.
Ejemplos de concentración química
- La concentración de la sal en el agua marina es de 35 g/L, lo que corresponde a una molaridad de 0,60 mol/L.
- La concentración promedio de azúcar en la sangre se encuentra entre 82 mg/dL y 110 mg/dL. Estas concentraciones equivalen en título simple a 0,82 g/L y 1,10 g/L, y en molaridad a 4,4.10-3 mol/L y 6,1.10-3 mol/L, respectivamente.
- El aire se puede considerar una solución gaseosa formada principalmente por nitrógeno y oxígeno, siendo el nitrógeno el solvente, ya que se encuentra en mayor proporción. Esta solución gaseosa contiene una fracción molar de oxígeno de 0,22 y de nitrógeno de aproximadamente 0,78.
- El acero es una aleación entre el hierro y el carbono. Aunque no son estrictamente soluciones, estas son mezclas sólidas homogéneas que suelen contener una concentración de carbono en el orden de 0,03% y 1,075% en masa.
- A pesar de sus efectos devastadores para el medio ambiente y para la salud de los seres humanos, las concentraciones de muchos contaminantes suelen ser considerablemente bajas. Un ejemplo es la concentración máxima del metal venenoso arsénico en el agua. La Organización Mundial de la Salud (OMS) estableció que el agua para beber no debe contener una concentración de arsénico superior a 10ppb m/V (partes por billón o nanogramos por litro). Esta concentración equivale a 0.010 ppm m/V.
Referencias
- BBC (s. f.). Concentration of solutions – Calculations in chemistry – AQA – GCSE Chemistry (Single Science) Revision – AQA. Tomado de bbc.co.uk.
- Here’s What Concentration Means in Chemistry (2020). Tomado de thoughtco.com.
- Libretexts (2022). 4.5: Concentration of Solutions. Tomado de chem.libretexts.org.
- Mandal, A., MD. (2021). Valores Normales del Azúcar de Sangre. Tomado de news-medical.net.
- Químicas.NET (s. f.). Concentraciones Químicas. Tomado de quimicas.net.
