Ácido hiposulfuroso: qué es, fórmulas, características, usos
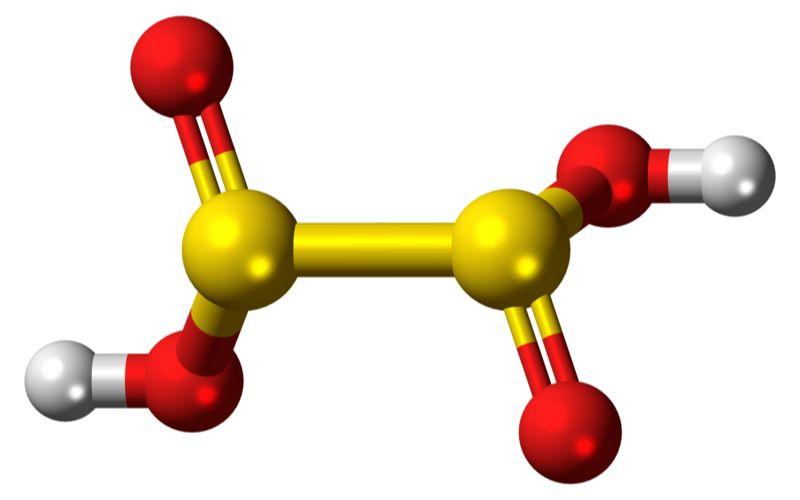
¿Qué es el ácido hiposulfuroso?
El ácido hiposulfuroso, o ácido ditionoso, es desconocido, inestable en forma pura, no tiene existencia independiente y tampoco se ha detectado en solución acuosa.
Teóricamente, sería un ácido relativamente débil, comparable al ácido sulfuroso, H2SO3. Solo se conocen sus sales, los ditionitos, que sí son estables y son poderosos agentes reductores. La sal sódica de ácido ditionoso es el ditionito de sodio.
Fórmulas
Las fórmulas del ácido hiposulfuroso son las siguientes:
Ácido ditionoso: H2S2O4
Anión ditionito: S2O42−
Ditionito de sodio: NA2S2O4
Número CAS: 20196-46-7 ácido hiposulfuroso (o ditionoso)
Número CAS: 14844-07-6 ácido hiposulfuroso (o ditionoso, ion)
Número CAS: 7775-14-6 ditionito de sodio (sal sódica de ácido ditionoso)
Propiedades físicas y químicas
– En la sal de ditionito de sodio, su apariencia es un polvo cristalino, de blanco a grisáceo, con copos de un verde limón claro y débil olor a azufre.
– El peso molecular del ácido ditionoso es 130.132 g/mol. El del anión ditionito, 128.116 g/mol, y el del ditionito de sodio, 174.096 g/mol.
– En el punto de ebullición del ditionito de sodio, se descompone, y su punto de fusión es de 52° C.
– La densidad del ditionito de sodio es de 2.38 g/cm³ (anhydrous), y su solubilidad en agua es 18.2 g/100 mL (anhydrous, 20 °C).
– El ácido hiposulfuroso es un oxoácido de azufre con la fórmula química H2S2O4.
– Los oxoácidos de azufre son compuestos químicos que contienen azufre, oxígeno e hidrógeno. Sin embargo, algunos de ellos solo se conocen por sus sales (como el ácido hiposulfuroso, el ácido ditiónico, el ácido disulfuro y el ácido sulfuroso).
Entre las características estructurales de los oxoácidos tenemos:
– Azufre tetraédrico cuando se coordina con oxígeno.
– Átomos de oxígeno en puente y terminal.
– Grupos peroxo terminales.
– S=S terminales.
– Cadenas de (-S-) n
El ácido sulfúrico es el oxoácido de azufre más conocido y el más importante industrialmente.
– El anión ditionito ([S2O4] 2-) es un oxoanión (un ion con la fórmula genérica AXOY z-) de azufre formalmente derivado del ácido ditiónico.
– Los iones ditionito experimentan hidrólisis tanto ácida como alcalina a tiosulfato y bisulfito, y sulfito y sulfuro.
– La sal sódica de ácido ditionoso es el ditionito de sodio (también conocido como hidrosulfito de sodio).
– Puede obtenerse a partir de bisulfito de sodio mediante la siguiente reacción:
2 NaHSO3 + Zn → Na2SO4 + Zn(OH)²
Usos
El ion ditionito se utiliza, a menudo en conjunción con un agente complejante (por ejemplo, ácido cítrico), para reducir el oxi-hidróxido de hierro (III) en compuestos solubles de hierro (II) y eliminar las fases minerales amorfas que contienen hierro (III) en el análisis de suelos (extracción selectiva).
El ditionito permite aumentar la solubilidad del hierro. Gracias a la fuerte afinidad del ion ditionito por los cationes metálicos bivalentes y trivalentes, es usado como agente quelante.
La descomposición del ditionito produce especies reducidas de azufre que pueden ser muy agresivas para la corrosión del acero y del acero inoxidable.
Entre las aplicaciones del ditionito de sodio tenemos:
En la industria
– Este compuesto es una sal soluble en agua, y puede usarse como agente reductor en soluciones acuosas.
– Se utiliza como tal en algunos procesos de tintura industrial, principalmente aquellos que implican tintes de azufre y tintes en tinas, en los que un colorante insoluble en agua puede ser reducido a una sal de metal alcalino soluble en agua (por ejemplo, el colorante índigo).
– Las propiedades de reducción del ditionito de sodio también eliminan el exceso de colorante, el óxido residual y los pigmentos no deseados, mejorando así la calidad global del color.
– El ditionito de sodio también se puede usar para el tratamiento de agua, purificación de gas, limpieza y extracción. También puede usarse en procesos industriales como un agente sulfonante o una fuente de ion sodio.
– Además de la industria textil, este compuesto se utiliza en las industrias relacionadas con el cuero, los alimentos, los polímeros, la fotografía, y muchos otros. También se utiliza como agente decolorante en reacciones orgánicas.
En las ciencias biológicas
– El ditionito de sodio se utiliza a menudo en experimentos de fisiología como un medio para reducir el potencial redox de las soluciones.
En las ciencias geológicas
– El ditionito de sodio se utiliza a menudo en experimentos de química del suelo para determinar la cantidad de hierro que no se incorpora en minerales de silicato primarios.
Seguridad y riesgos
La manipulación de este elemento se debe hacer en condiciones de extremo cuidado. Es extremadamente tóxico y puede reaccionar de forma peligrosa en conjunción con el agua y con el aire.
A continuación, destacamos algunos aspectos.
Reacciones de aire y agua
– El ditionito sódico es un sólido combustible que se descompone lentamente cuando está en contacto con agua o vapor de agua, formando tiosulfatos y bisulfitos.
– Esta reacción produce calor, que puede acelerar aún más la reacción o provocar que los materiales circundantes se quemen. Si la mezcla está confinada, la reacción de descomposición puede dar como resultado la presurización del recipiente, que puede romperse con fuerza. Al permanecer en el aire, se oxida lentamente, generando gases tóxicos de dióxido de azufre.
Peligro de incendio
– El ditionito sódico es un material inflamable y combustible. Puede inflamarse al contacto con el aire húmedo o la humedad. Puede quemarse rápidamente con efecto de llamarada. Puede reaccionar vigorosamente o explosivamente en contacto con el agua.
– Puede descomponerse en forma explosiva cuando se calienta o se encuentra envuelto en un incendio. Puede volver a encenderse después de que el fuego se extingue. La escorrentía puede crear peligro de incendio o explosión. Los contenedores pueden explotar cuando se calientan.
Peligro para la salud
– Al entrar en contacto con el fuego, el ditionito sódico producirá gases irritantes, corrosivos y/o tóxicos. La inhalación de productos de descomposición puede causar lesiones graves o la muerte. El contacto con la sustancia puede causar quemaduras graves en la piel y los ojos. La escorrentía del control de incendios puede causar contaminación.
Referencias
- Benjah-bmm27 (2006). A ball-and-stick model of the dithionite ion [imagen] Recuperado de en.wikipedia.org.
- Mills, B. (2009). Sodium-dithionite-xtal-1992-3D-balls [imagen] Recuperada de: en.wikipedia.org.
