¿Qué es la Volatilización?
La volatilización es el proceso de convertir una sustancia química de un estado líquido o sólido a un estado gaseoso o de vapor. Otros términos usados para describir el mismo proceso son vaporización, destilación y sublimación.
Una sustancia se puede separar a menudo de otra por la volatilización y puede entonces ser recuperada por la condensación del vapor.
La sustancia se puede volatilizar más rápidamente ya sea calentándola para aumentar su presión de vapor o mediante la eliminación del vapor usando una corriente de gas inerte o una bomba de vacío.
Los procedimientos de calentamiento incluyen la volatilización del agua, del mercurio o del tricloruro de arsénico para separar estas sustancias de los elementos interferentes.
A veces se utilizan reacciones químicas para producir productos volátiles como en la liberación de dióxido de carbono a partir de carbonatos, amoniaco en el método Kjeldahl para la determinación de nitrógeno y dióxido de azufre en la determinación de azufre en acero.
Los métodos de volatilización se caracterizan generalmente por una gran simplicidad y facilidad de operación, excepto cuando se necesitan temperaturas altas o materiales altamente resistentes a la corrosión (Louis Gordon, 2014).
Volatización por presión de vapor
A sabiendas de que la temperatura de ebullición del agua son 100 °C, alguna vez te has preguntado ¿por qué el agua de lluvia se evapora?
¿Está a 100 °C? de ser así, ¿por qué no me da calor? Alguna vez te has preguntado ¿qué le da el aroma característico al alcohol, al vinagre, a la madera o al plástico? (Vapor Pressure, S.F.)
El responsable de todo esto es una propiedad conocida como presión de vapor, la cual es la presión ejercida por un vapor en equilibrio con la fase sólida o líquida de la misma sustancia.
También, la presión parcial de la sustancia en la atmósfera sobre el sólido o el líquido (Anne Marie Helmenstine, 2014).
La presión de vapor es una medida de la tendencia de un material a cambiar al estado gaseoso o de vapor, es decir, una medida de la volatilidad de las sustancias.
A medida de que aumenta la presión de vapor, mayor será la capacidad del líquido o del sólido de evaporarse siendo así más volátil.
La presión de vapor aumentará con la temperatura. La temperatura a la cual la presión de vapor en la superficie de un líquido es igual a la presión ejercida por el entorno se llama el punto de ebullición del líquido (Encyclopædia Britannica, 2017).
La presión de vapor dependerá del soluto disuelto en solución (es una propiedad coligativa). En la superficie de la solución (interfase aire-gas) las moléculas más superficiales tienden a evaporarse, intercambiándose entre fases y generando una presión de vapor.
La presencia de soluto, disminuye el número de moléculas de solvente en la interfase, reduciendo la presión de vapor.
El cambio de la presión de vapor se puede calcular con la Ley de Raoult para solutos no volátiles la cual está dada por:

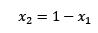
Donde X2 es la fracción molar del solvente. Si multiplicamos ambos lado de la ecuación por P° entonces queda:
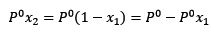
Sustituyendo (1) en (3) queda:
(4)
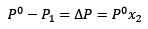
Esta es la variación de la presión de vapor cuando se disuelve un soluto (Jim Clark, 2017).
Análisis gravimétrico
El análisis gravimétrico es una clase de técnicas de laboratorio utilizadas para determinar la masa o concentración de una sustancia midiendo un cambio en la masa.
El químico que estamos tratando de cuantificar es a veces llamado el analito. Podríamos utilizar el análisis gravimétrico para responder preguntas tales como:
- ¿Cuál es la concentración del analito en una solución?
- ¿Qué tan pura es nuestra muestra? La muestra aquí podría ser un sólido o en solución.
Hay dos tipos comunes de análisis gravimétrico. Ambos implican el cambio de la fase del analito para separarla del resto de una mezcla, dando lugar a un cambio en la masa.
Uno de estos métodos es la gravimetría de precipitación, pero el que en realidad nos interesa es la gravimetría de volatilización.
La gravimetría de volatilización se basa en descomponer térmicamente o químicamente la muestra y medir el cambio resultante en su masa.
Alternativamente, podemos atrapar y pesar un producto volátil de la descomposición. Debido a que la liberación de una especie volátil es una parte esencial de estos métodos, los clasificamos colectivamente como métodos de análisis gravimétricos de volatilización (Harvey, 2016).
Los problemas de análisis gravimétrico son simplemente problemas de estequiometría con unos pocos pasos adicionales.
Para realizar cualquier cálculo estequiométrico, necesitamos los coeficientes de la ecuación química equilibrada.
Por ejemplo, si una muestra contiene impurezas de cloruro de bario dihidratado (BaCl2●H2O), se puede obtener la cantidad de impurezas calentando la muestra para evaporar el agua.
La diferencia de masas entre la muestra original y la muestra calentada nos dará, en gramos, la cantidad de agua contenida en el cloruro de bario.
Con un simple cálculo estequimétrico se obtendrá la cantidad de impurezas de la muestra (Khan, 2009).
Destilación fraccionada
La destilación fraccionada es un proceso mediante el cual los componentes de una mezcla líquida se separan en diferentes partes (llamadas fracciones) de acuerdo con sus diferentes puntos de ebullición.
La diferencia de volatilidades de los compuestos de la mezcla juega un papel fundamental en su separación.
La destilación fraccionada se utiliza para purificar productos químicos y también para separar las mezclas para obtener sus componentes. Se utiliza como una técnica de laboratorio y en la industria, donde el proceso tiene una gran importancia comercial.
Los vapores de una solución hirviendo se pasan a lo largo de una columna alta, denominada columna de fraccionamiento.
La columna se embala con perlas de plástico o de vidrio para mejorar la separación proporcionando más área superficial para la condensación y la evaporación.
La temperatura de la columna disminuye gradualmente a lo largo de su longitud. Los componentes con un punto de ebullición más alto se condensan en la columna y retornan a la solución.
Los componentes con puntos de ebullición más bajos (más volátiles) pasan a través de la columna y se recogen cerca de la parte superior.
Teóricamente, tener más perlas o placas mejora la separación, pero la adición de placas también aumenta el tiempo y la energía requeridos para completar una destilación (Helmenstine, 2016).
Referencias
- Anne Marie Helmenstine. (2014, Mayo 16). Vapor Pressure Definition. Recuperado de thoughtco.com.
- Encyclopædia Britannica. (2017, Febrero 10). Vapour pressure. Recuperado de britannica.com.
- Harvey, D. (2016, Marzo 25). Volatilization Gravimetry. Recuperado de chem.libretexts.
- Helmenstine, A. M. (2016, Noviembre 8). Fractional Distillation Definition and Examples. Recuperado de thoughtco.com.
- Jim Clark, I. L. (2017, Marzo 3). Raoult’s Law. Recuperado dechem.libretexts.
- Khan, S. (2009, Agosto 27). Introduction to gravimetric analysis: Volatilization gravimetry. Recuperado de khanacademy.
- Louis Gordon, R. W. (2014). Recuperado de accessscience.com.
- Vapor Pressure. (S.F.). Recuperado de chem.purdue.edu.
