Metil o grupo metilo
El metil o grupo metilo es un sustituyente alquílico cuya fórmula química es CH3. Es el más simple de todos los sustituyentes carbonados en química orgánica, posee un solo carbono y tres hidrógenos; deriva del gas metano. Debido a que únicamente puede enlazarse a otro carbono, su posición indica el final de una cadena, su terminación.
En la imagen de abajo se tiene una de las tantas representaciones para este grupo. Las sinuosidades a su derecha señalan que detrás del enlace H3C- puede haber cualquier átomo o sustituyente; uno alquílico, R, aromático o arilo, Ar, o un heteroátomo o grupo funcional, como OH o Cl.
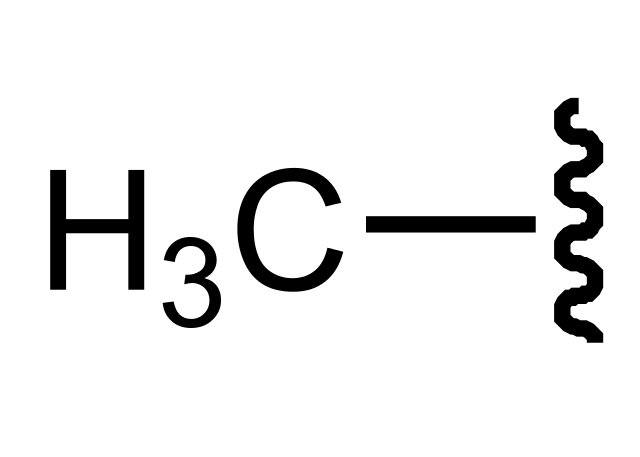
Cuando el grupo funcional enlazado al metilo es OH, tenemos al alcohol metanol, CH3OH; y si se trata del Cl, entonces tendremos al cloruro de metilo, CH3Cl. En la nomenclatura orgánica se le menciona simplemente como ‘metil’ precedido por el número de su posición en la cadena carbonada más larga.
El grupo metilo CH3 es fácil de identificar durante las elucidaciones de estructuras orgánicas, especialmente gracias a la espectroscopia de resonancia magnética nuclear del carbono 13 (RMN C13). De él tras fuertes oxidaciones se obtienen grupos ácidos COOH, siendo una ruta sintética para sintetizar ácidos carboxílicos.
Índice del artículo
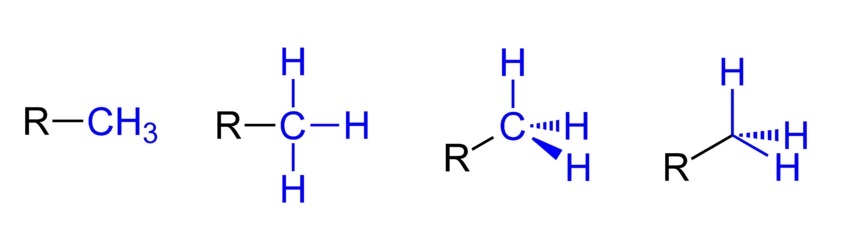
Arriba se tienen las cuatro representaciones posibles asumiendo que el CH3 está enlazado a un sustituyente alquílico R. Todas son equivalentes, pero mientras se va de izquierda a derecha se evidencia los aspectos espaciales de la molécula.
Por ejemplo, R-CH3 da la impresión de que es plana y lineal. La representación que sigue, demuestra los tres enlaces covalentes C-H, los cuales permiten identificar al metilo en cualquier estructura de Lewis y dan la falsa impresión de ser una cruz.
Luego, siguiendo a la derecha (la penúltima), se observa la hibridación sp3 en el carbono del CH3 a causa de su geometría tetraédrica. En la última representación ni siquiera se escribe el símbolo químico del carbono, pero se mantiene el tetraedro para indicar cuáles átomos H están frente o detrás del plano.
Aunque no está en la imagen, otro modo muy recurrente al momento de representar al CH3 consiste en simplemente colocar el guión (-) “desnudo”. Esto resulta de mucha utilidad cuando se dibujan esqueletos carbonados grandes.
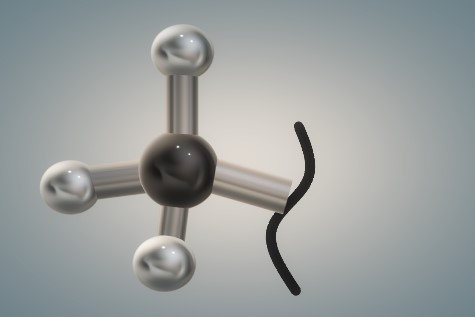
La imagen superior es la representación tridimensional de la primera. La esfera negra y lustrosa corresponde al átomo de carbono, mientras que las blancas son los átomos de hidrógeno.
Nuevamente, el carbono tiene un entorno tetraédrico producto de su hibridación sp3, y como tal es un grupo relativamente voluminoso, con las rotaciones de su enlace C-R impedidas estéricamente; es decir, no puede rotar porque las esferas blancas interferirían con las nubes electrónicas de sus átomos vecinos y sentirían su repulsión.
No obstante, los enlaces C-H sí pueden vibrar, al igual que el enlace C-R. Por lo tanto, el CH3 es un grupo de geometría tetraédrica que puede elucidarse (determinarse, averiguarse) por espectroscopia de radiación infrarroja (IR), al igual que todos los grupos funcionales y enlaces de carbono con heteroátomos.
Lo más importante, sin embargo, es su elucidación mediante RMN-C13. Gracias a esta técnica se determina la cantidad relativa de grupos metilo, lo cual permite armar la estructura molecular.
Generalmente, mientras más grupos CH3 tenga una molécula, más “torpes” o ineficientes serán sus interacciones intermoleculares; es decir, menores serán sus puntos de fusión y ebullición. Los grupos CH3, a causa de sus hidrógenos, “resbalan” entre sí cuando se aproximan o tocan.
El grupo metilo se caracteriza por ser en esencia hidrofóbico y apolar.
Esto se debe a que sus enlaces C-H son poco polares a causa de la baja diferencia entre las electronegatividades del carbono e hidrógeno; y además, su geometría tetraédrica y simétrica distribuye de manera casi homogénea sus densidades electrónicas, lo cual contribuye a un momento dipolar despreciable.
En ausencia de la polaridad, el CH3 “rehúye” del agua, comportándose como un hidrófobo. Por eso, si se le ve en una molécula se sabrá que ese extremo metílico no interaccionará eficientemente con el agua ni con otro solvente polar.
Otra característica del CH3 es su relativa estabilidad. A menos que el átomo que esté enlazado a él le retire densidad electrónica, permanece prácticamente inerte frente a medios ácidos muy fuertes. Sin embargo, se verá que sí puede participar en reacciones químicas, principalmente a lo que respecta su oxidación, o migración (metilación) a otra molécula.
El CH3 no está exento a oxidarse. Esto significa que es susceptible a formar enlaces con el oxígeno, C-O, si reacciona con agentes oxidantes fuertes. A medida que se oxida se transforma en diferentes grupos funcionales.
Por ejemplo, su primera oxidación da lugar al grupo metiol (o hidroximetil), CH2OH, un alcohol. La segunda, deriva en el grupo formilo, CHO (HC=O), un aldehído. Y la tercera, finalmente, permite su conversión en el grupo carboxilo, COOH, un ácido carboxílico.
Esta serie de oxidaciones se aprovecha para sintetizar ácido benzoico (HOOC-C6H5) a partir del tolueno (H3C-C6H5).
El CH3 durante el mecanismo de algunas reacciones puede ganar momentáneas cargas eléctricas. Por ejemplo, cuando el metanol se calienta en un medio ácido muy fuerte, en ausencia teórica de nucleófilos (buscadores de cargas positivas), se forma el catión metílico, CH3+, ya que se rompe el enlace CH3-OH y el OH sale con el par de electrones del enlace.
La especie CH3+ es tan reactiva que solamente ha podido determinársele en la fase gaseosa, ya que reacciona o desaparece a la menor presencia de un nucleófilo.
Por otro lado, del CH3 también puede obtenerse un anión: el metanuro, CH3–, el carbanión más simple de todos. Sin embargo, al igual que el CH3+, su presencia es anormal y solamente tiene lugar en condiciones extremas.
En la reacción de metilación se transfiere un CH3 a una molécula sin que se produzcan cargas eléctricas (CH3+ ni CH3–) en el proceso. Por ejemplo, el yoduro de metilo, CH3I, es un buen agente metilante, y puede sustituir el enlace O-H de varias moléculas por uno O-CH3.
En síntesis orgánicas esto no conlleva ninguna tragedia; pero sí cuando lo que se metila en exceso son las bases nitrogenadas del ADN.
- Morrison, R. T. y Boyd, R, N. (1987). Química Orgánica. 5ta Edición. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. Amines. (10th edition.). Wiley Plus.
- Rahul Gladwin. (23 de noviembre de 2018). Methylation. Encyclopædia Britannica. Recuperado de: britannica.com
- Danielle Reid. (2019). Methyl Group: Structure & Formula. Study. Recuperado de: study.com
- Wikipedia. (2019). Methyl group. Recuperado de: en.wikipedia.org
