Fosfato de amonio: estructura, propiedades, obtención, usos
El fosfato de amonio es una familia de compuestos salinos que derivan de la reacción entre el ácido fosfórico y el amoníaco. De acuerdo a la nomenclatura inorgánica, este nombre correspondería a la sal cuya fórmula química es (NH4)3PO4, compuesta por cationes amonio, NH4+, y aniones fosfatos, PO43-.
En la imagen inferior se muestra una representación de estos iones. El (NH4)3PO4 se conoce también como fosfato tribásico de amonio o fosfato de triamónico. Estos nombres se deben a que, tal como se observa, el PO43- tiene disponibles tres oxígenos negativos capaces de aceptar protones, H+, de un ácido circundante.
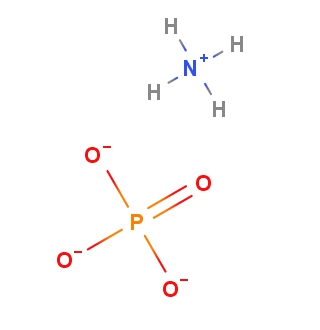
Y precisamente esto es lo que sucede con los NH4+ de su propia estructura. Por lo tanto, el fosfato de amonio es inestable, descomponiéndose en NH4H2PO4 y NH3. Es por eso que esta sal despide un fuerte olor amoniacal.
Las otras sales de fosfatos de amonio son más estables y útiles. Por ejemplo, se utilizan en la agricultura como materiales fertilizantes, y los cristales de algunas de ellas inclusive tienen aplicaciones ópticas y físicas.
Esta familia de sales es simple pero diversa cuando se cambia la acidez del medio donde se encuentra.
Índice del artículo
El fosfato de amonio se compone de iones NH4+ y PO43-, ambos de geometrías tetraédricas. Los electrones del PO43- se distribuyen entre los tres átomos de oxígeno de los enlaces P-O–, cuya carga negativa atrae fuertemente al NH4+. Por lo tanto, podría pensarse que la estructura cristalina del (NH4)3PO4 es fuerte.
En ella, los iones NH4+ y PO43- se encuentran en una proporción 3:1, lo que significa que en sus cristales hay el triple de iones NH4+ que de iones PO43-. Así, sus interacciones electrostáticas terminan definiendo un cristal tetragonal.
Lo mismo ocurre en parte con las otras sales de este fosfato: (NH4)2HPO4 y NH4H2PO4, en las cuales el PO43- ha ganado uno o dos H+, respectivamente. En sus cristales, principalmente tetragonales, las interacciones electrostáticas son más débiles a causa de sus menores cargas iónicas.
No obstante, son energéticamente más estables, en especial NH4H2PO4, pues presenta el mayor punto de fusión.
Por otro lado, las sales de fosfato de amonio también pueden formar hidratos, incorporando moléculas de agua a sus estructuras cristalinas.
(NH4)3PO4
Esta fórmula, siguiendo estrictamente la nomenclatura inorgánica, corresponde a la sal fosfato de amonio. Otros nombres aceptados son:
-Fosfato tribásico de amonio
-Fosfato de triamonio o triamónico
(NH4)2HPO4
Esta sal presenta varios nombres de acuerdo a la nomenclatura de preferencia. Los más comunes, aparte del fosfato diamónico, son:
-Fosfato ácido de amonio
-Fosfato dibásico de amonio
A diferencia del (NH4)3PO4, se compone de iones NH4+ y HPO42- en una proporción 2:1.
NH4H2PO4
Esta sal corresponde a la “versión más ácida” del fosfato de amonio. En ella, el PO43- ha ganado dos H+, reduciendo así su carga iónica a H2PO4–. Por lo tanto, sus nombres más comunes son:
-Fosfato monobásico de amonio (porque apenas tiene un oxígeno capaz de aceptar protones)
-Fosfato diácido de amonio
Algunos de los nombres anteriores también pueden cambiarse por:
-Dihidrógeno fosfato de amonio
-Fosfato monoamónico
Como puede verse, son muchos los nombres posibles. Lo importante es saber relacionarlos directamente con las fórmulas de cualquiera de las tres sales correspondientes a la familia de los fosfatos de amonio.
(NH4)3PO4: 149.09 g/mol
(NH4)2HPO4: 132.06 g/mol
NH4H2PO4: 115.025 g/mol
Las sales de fosfato de amonio comparten en común que todas son blancas. A excepción del fosfato triamónico o tribásico de amonio, las demás sales no despiden un olor amoniacal en condiciones normales.
El (NH4)3PO4 se descompone antes de que pueda fundirse. Mientras, el (NH4)2HPO4 funde a 155 ºC, y el NH4H2PO4 a 190 ºC. El mayor punto de fusión de NH4H2PO4 indica una mayor estabilidad y un enlace iónico más fuerte.
Inmedibles, ya que se descomponen al fundirse.
Las sales de fosfato de amonio son muy solubles en agua, siendo el (NH4)3PO4 un sólido higroscópico. Sin embargo, son insolubles en etanol, acetona y amoníaco líquido.
Todas las sales de fosfato de amonio tienen el potencial de liberar amoníaco al descomponerse. Asimismo, dependiendo de la intensidad del calor, se descomponen en ácido fosfórico para finalmente liberar gases nocivos de óxidos de nitrógeno y fósforo.
Las sales de fosfato de amonio se obtienen mediante la reacción de neutralización ocurrida entre el ácido fosfórico y el amoníaco:
H3PO4 + 3 NH3 → (NH4)3PO4
Como puede verse, si se desea obtener fosfatos de amonio “menos básicos”, lo que es igual a decir “más ácidos”, es necesario variar las proporciones de los reactivos que se añaden al reactor. Generalmente, se utiliza el óxido fosfórico, P2O5, como fuente de fósforo para su respectivo ácido.
Mientras más H3PO4 haya, mayor será la producción del NH4H2PO4 o (NH4)2HPO4 (más ácidos) que de (NH4)3PO4 (más básico).
De hecho, son el NH4H2PO4 (MAP, por sus siglas en inglés: monoammonium phosphate) y el (NH4)2HPO4 (DAP) las sales de fosfato de amonio que tienen mayor valor comercial. Mientras, el (NH4)3PO4 es la que menos se comercializa, precisamente por ser la más inestable y, posiblemente, la más costosa de preparar.
Una de las consecuencias inmediatas del párrafo anterior, es que la mayoría de los usos que tienen las sales de fosfato de amonio se deban a NH4H2PO4 y (NH4)2HPO4. El (NH4)3PO4, en cambio, no tiene casi ningún uso, pues se descompone rápidamente.

Las sales de fosfato de amonio son buenas fertilizantes, ya que aportan dos nutrientes esenciales para el desarrollo de las plantas: nitrógeno y fósforo. Además, son solubles en agua, por lo que rápidamente pasan a estar disponibles en el suelo para su debida absorción a través de las raíces.
Se almacenan sin ningún problema, y a menos que haya un incendio, no desprenden amoníaco, gas que puede dañar los tejidos vegetales.

Las sales de fosfato de amonio al descomponerse liberan varios gases que, si bien son nocivos, desplazan el oxígeno del aire en plenos incendios. Es por eso que se usan como retardantes de fuego. De esta manera, se frena o retarda el avance de las llamas.
El NH4H2PO4 se utiliza en aplicaciones óptica debido a que sus cristales muestran birefrigencia, es decir, tienen doble refracción. Asimismo, poseen propiedades piezoeléctricas, razón por la que se utilizan en los transductores.
- Shiver & Atkins. (2008). Química Inorgánica. (cuarta edición). Mc Graw Hill.
- Wikipedia. (2020). Ammonium phosphate. Recuperado de: en.wikipedia.org
- Elsevier B.V. (2020). Ammonium Phosphate. ScienceDirect. Recuperado de: sciencedirect.com
- Diane Milner. (04 de febrero de 2019). The Many Uses of Ammonium Phosphate. Noah Technologies. Recuperado de: info.noahtech.com
- National Center for Biotechnology Information. (2020). Tribasic ammonium phosphate. PubChem Database., CID=57517680. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Milek J.T., Neuberger M. (1972) Ammonium Dihydrogen Phosphate (ADP). In: Linear Electrooptic Modular Materials. Springer, Boston, MA.
- The Mosaic Company. (2020). Monoammonium Phosphate (MAP). Recuperado de: cropnutrition.com
