Enlace covalente triple: concepto, características, ejemplos
¿Qué es un enlace covalente triple?
Los enlaces covalentes triples son enlaces químicos en los que dos átomos comparten tres pares de electrones. Es decir que son enlaces covalentes formados por un total de seis electrones de valencia que giran en torno a dos átomos.
Existen muchos compuestos químicos que contienen enlaces triples. Por ejemplo, los compuestos orgánicos tales como los alquinos contienen enlaces covalentes triples C-C. Los nitrilos también se caracterizan por poseer un grupo que contiene un carbono enlazado a un nitrógeno por medio de un enlace covalente triple C-N. Otros compuestos inorgánicos tales como el nitrógeno molecular en el aire, también contienen enlaces covalentes triples.
Tener 6 electrones girando alrededor de dos núcleos les da a los enlaces triples muchas características particulares. Tanto la forma de las moléculas que las contienen, como las reacciones químicas en las que pueden participar son diferentes de las de los enlaces dobles o simples.
Características del enlace covalente triple
Están formados por 6 electrones
Estos enlaces están formados por 6 electrones y se forman cuando cada uno de los dos átomos involucrados comparte tres de sus electrones desapareados con el otro. Esta es la razón por la que se denominan enlaces triples, ya que poseen el triple del número de electrones del enlace covalente simple.
Poseen un enlace sigma (σ) y dos enlaces pi (π)
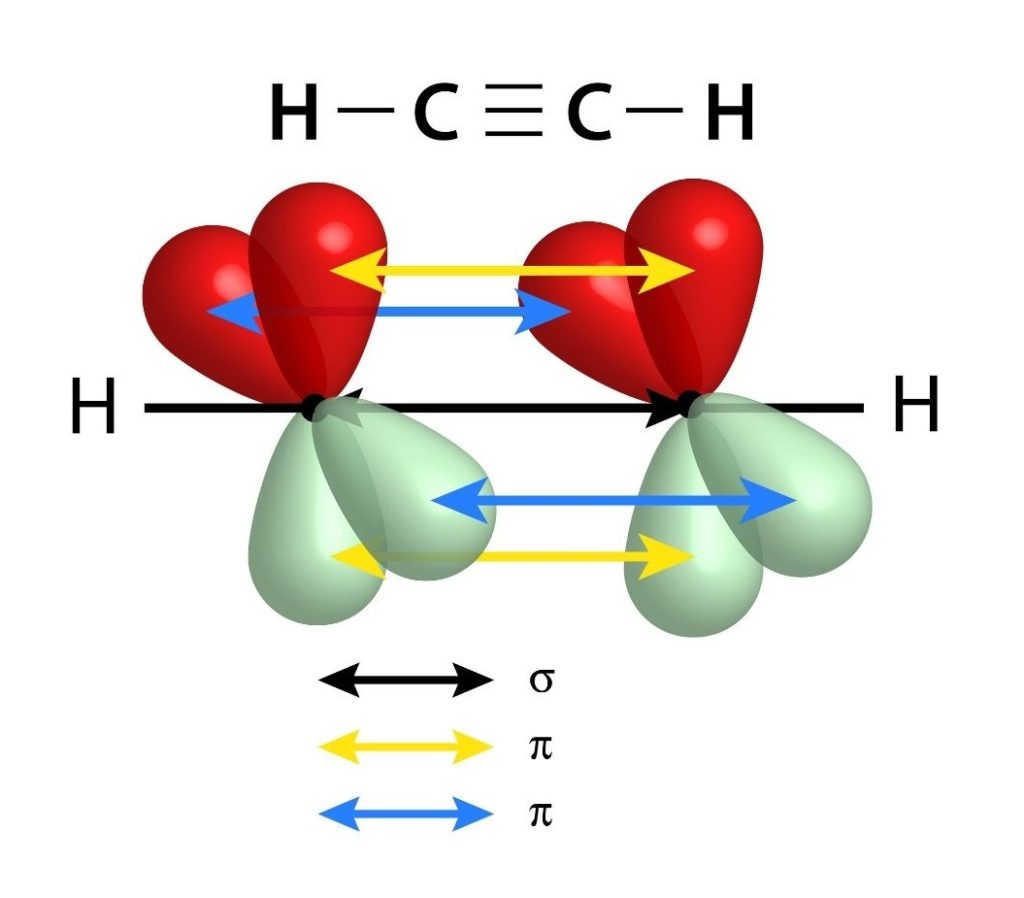
De forma similar a los enlaces dobles, los enlaces triples también están formados por un enlace sigma que pasa por el centro de la línea que une a los dos átomos enlazados. Sin embargo, a diferencia de los enlaces dobles que poseen uno, los enlaces triples poseen dos enlaces pi además del enlace sigma.
Casi siempre forman compuestos lineales
Cuando dos átomos de carbono forman un enlace triple, aún les queda a cada uno la posibilidad de formar un enlace simple adicional con otro átomo (ya que el carbono puede formar 4 enlaces en total).
En estos casos, tanto los dos carbonos como los otros dos átomos unidos a éstos, formarán una línea recta. Esta forma que adquiere la molécula se denomina geometría lineal.
Son los enlaces covalentes más fuertes
Al comparar los enlaces triples entre dos átomos con los enlaces dobles y simples entre esos mismos átomos, se observa que los enlaces triples siempre son más fuertes que los demás tipos de enlace covalente. Esto significa que es más difícil romper un enlace triple que uno doble o simple.
Esto se debe a que, además tener que romper el enlace sigma (que también está presente tanto en los enlaces simples como en los dobles), hay que romper no uno (como en los enlaces dobles) sino dos enlaces pi adicionales.
Son más cortos que los enlaces dobles o que los simples
Por el mismo hecho de ser enlaces más fuertes, los enlaces triples logran acercar más los núcleos de los átomos entre sí, lo que hace que los enlaces triples sean más cortos que los enlaces dobles y simples.
Representan dos insaturaciones
Cada carbono que posee un enlace triple poseerá solo un enlace adicional con otro átomo. Esto significa que dicho carbono estaría enlazado solo a dos átomos, en lugar de a cuatro, por lo que posee menos hidrógenos de los que podría poseer si solo formara enlaces simples.
A esto se le llama insaturación, y los compuestos con enlaces triples tienen dos insaturaciones, ya que a cada uno de los dos carbonos les cabrían 2 hidrógenos adicionales, de no ser por el enlace triple.
Son enlaces rígidos
Al igual que los enlaces dobles, los enlaces triples son rígidos y difíciles de doblar o torcer. Esto se debe tanto a la mayor fuerza de enlace como a la menor longitud.
Pueden actuar como bases
Algunos compuestos con enlaces triples pueden utilizar los electrones pi de dicho enlace para enlazarse o aceptar iones H+, por lo tanto, actuando como bases.
Se pueden hidrogenar para dar enlaces dobles o simples
Las insaturaciones del enlace triple se pueden eliminar rompiendo los enlaces pi y añadiendo hidrógenos a los dos carbonos. Esto se denomina hidrogenación. Si se añade solo una molécula de hidrógeno a un enlace triple, este se convertirá en un enlace doble. Si se agregan dos moléculas de hidrógeno, se convertirá en un enlace simple.
Ejemplos de enlaces covalentes triples
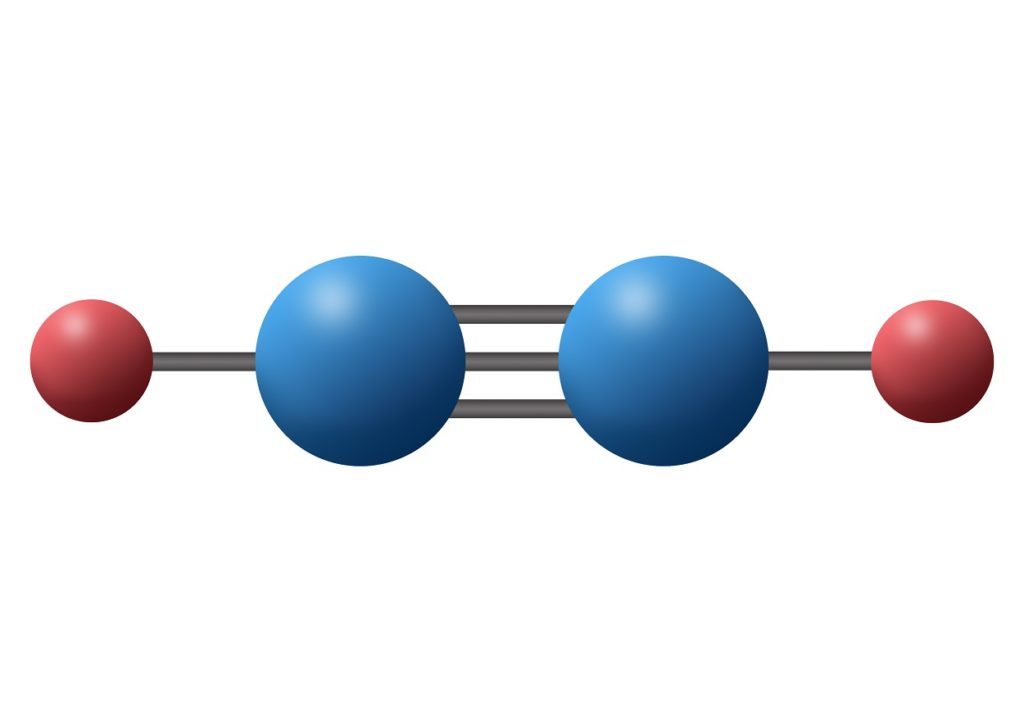
Molécula de nitrógeno (N2)
La molécula de nitrógeno contiene un enlace covalente triple entre los dos átomos de nitrógeno. Cada átomo comparte sus tres electrones de valencia desapareados con el otro, y cada nueva pareja de electrones pasa a formar bien sea el enlace sigma o uno de los dos enlaces pi que posee la molécula.

En este caso, tanto los dos átomos de nitrógeno como los pares de electrones sin compartir que posee cada uno de ellos se encuentran ubicados a lo largo de una línea recta.
El propino (un alquino de fórmula C3H4)
El propino es el segundo alquino más simple que existe. Este compuesto está formado por una cadena de tres carbonos, dos de los cuales están enlazados por medio de un enlace covalente triple.
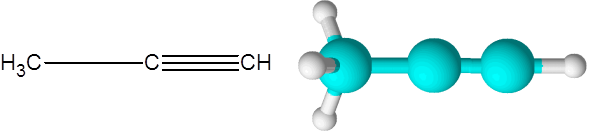
Aquí también se puede observar que los tres carbonos y el último átomo de hidrógeno (el que está a la derecha) forman una línea recta. En el modelo también se puede observar que el enlace C-C simple es más largo que el enlace C-C triple.
El monóxido de carbono (CO)
El monóxido de carbono es un gas inorgánico tóxico que posee un átomo de carbono negativo y un oxígeno positivo enlazados por medio de un enlace covalente triple. En este caso, se trata de un enlace polar, debido a la diferencia de electronegatividades entre el carbono y el oxígeno.

