Sulfuro de aluminio (Al2S3): estructura, propiedades, usos
El sulfuro de aluminio (Al2S3) es un compuesto químico de color gris claro formado por la oxidación del aluminio metálico al perder los electrones del último nivel de energía y convertirse en catión, y por la reducción del azufre no metálico, al ganar los electrones cedidos por el aluminio y convertirse en un anión.
Para que esto ocurra y el aluminio pueda ceder sus electrones, es necesario que presente tres orbitales híbridos sp3, que dan la posibilidad de formar enlaces con los electrones provenientes del azufre.
La sensibilidad del sulfuro de aluminio al agua implica que, en presencia del vapor de agua que se encuentra en el aire, puede reaccionar produciendo hidróxido de aluminio (Al(OH)3), sulfuro de hidrógeno (H2S) e hidrógeno (H2) gaseoso; si este último se acumula puede causar una explosión. Por ende, el embalaje del sulfuro de aluminio debe hacerse usando recipientes herméticos.
Por otro lado, dado que el sulfuro de aluminio tiene reactividad con el agua, esto lo convierte en un elemento que no tiene solubilidad en dicho solvente.
Estructura química
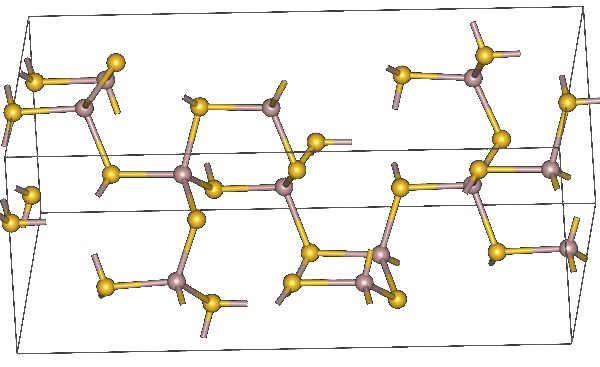
Fórmula molecular
Al2S3
Fórmula estructural
– Sulfuro de aluminio.
– Trisulfuro de di aluminio.
– Sulfuro de aluminio (III).
– Sulfuro alumínico.
Propiedades del sulfuro de aluminio
Los compuestos químicos en su mayoría exhiben dos clases de propiedades: físicas y químicas.
Propiedades físicas
Masa molar
150,158 g/mol
Densidad
2,02 g/mL
Punto de fusión
1100 °C
Solubilidad en Agua
Insoluble
Propiedades químicas
Una de las principales reacciones del sulfuro de aluminio es con agua, como sustrato o reactivo principal:

En esta reacción se puede observar la formación del hidróxido de aluminio y la del sulfuro de hidrógeno si se encuentra en forma de gas, o ácido sulfhídrico si se encuentra disuelto en el agua en forma de solución. Se identifica su presencia por el olor a huevos podridos.
Usos y aplicaciones
En supercondensadores
El sulfuro de aluminio es usado en la fabricación de estructuras de nano redes que mejoren el área de superficie específica y la conductividad eléctrica, de tal forma que se pueda lograr una alta capacitancia y densidad de energía cuya aplicabilidad sea la de supercondensadores.
El óxido de grafeno (GO) —el grafeno es una de las formas alotrópicas del carbono— ha servido como soporte del sulfuro de aluminio (Al2S3) con una morfología jerárquica similar a la del nanorambután fabricado utilizando el método hidrotermal.
Acción del óxido de grafeno
Las características del óxido de grafeno como soporte, así como la elevada conductividad eléctrica y el área de superficie, hacen que el nanorambutano Al2S3 sea electroquímicamente activo.
Las curvas de capacitancia específica CV con picos de redox bien definidos confirman el comportamiento pseudocapacitivo del nanorambutano Al2S3 jerárquico, sostenido en óxido de grafeno en electrolito de NaOH 1M. Los valores de capacitancia específica CV obtenidos de las curvas son: 168,97 a la velocidad de exploración de 5mV/s.
Además, se ha observado un buen tiempo de descarga galvanostática de 903 µs, una gran capacitancia específica de 2178,16 a la densidad de corriente de 3 mA/Cm2. La densidad de energía calculada a partir de la descarga galvanostática es de 108,91 Wh/Kg, a la densidad de corriente de 3 mA/Cm2.
La impedancia electroquímica confirma así la naturaleza pseudocapacitiva del electrodo de nanorambutano jerárquico Al2S3. La prueba de estabilidad del electrodo muestra una retención del 57,84 % de la capacitancia específica de hasta 1000 ciclos.
Los resultados experimentales sugieren que el nanorambutano Al2S3 jerárquico es adecuado para aplicaciones de supercondensadores.
En baterías secundarias de litio
Con la intención de desarrollar una batería secundaria de litio con alta densidad de energía, se estudió el sulfuro de aluminio (Al2S3) como material activo.
La capacidad de descarga inicial medida de Al2S3 fue de aproximadamente 1170 mAh g-1 a 100 mA g-1. Esto corresponde al 62 % de la capacidad teórica para el sulfuro.
El Al2S3 exhibió una retención de capacidad pobre en el rango potencial entre 0,01 V y 2,0 V, principalmente debido a la irreversibilidad estructural del proceso de carga o la extracción de Li.
Los análisis XRD y K-XANES para el aluminio y el azufre indicaron que la superficie de Al2S3 reacciona reversiblemente durante los procesos de carga y descarga, mientras que el núcleo de Al2S3 mostró irreversibilidad estructural, porque LiAl y Li2S se formaron a partir de Al2S3 en la descarga inicial y después permanecieron como estaban.
Riesgos
– En contacto con el agua libera gases inflamables que pueden arder espontáneamente.
– Causa irritación de la piel.
– Causa irritación ocular grave.
– Puede causar irritación respiratoria.
La información puede variar entre las notificaciones dependiendo de las impurezas, los aditivos y otros factores.
Procedimiento de primeros auxilios
Tratamiento general
Busque atención médica si los síntomas persisten.
Tratamiento especial
Ninguno
Síntomas importantes
Ninguno
Inhalación
Lleve a la víctima al aire libre. Suministre oxígeno si la respiración es difícil.
Ingestión
Administre uno o dos vasos de agua e induzca el vómito. Nunca inducir vomitar o dar cualquier cosa por la boca a una persona inconsciente.
Piel
Lave el área afectada con agua y jabón suave. Eliminar cualquier ropa contaminada.
Ojos
Lávese los ojos con agua, parpadeando a menudo durante varios minutos. Retirar lentes de contacto en caso de que los tenga y continuar enjuagando.
Medidas de lucha contra incendios
Inflamabilidad
No inflamable.
Medios de extinción
Reacciona con el agua. No use agua: use CO₂, arena y polvo extintor.
Procedimiento de lucha
Use un aparato de respiración autónomo de cara completa con protección completa. Use ropa para evitar el contacto con la piel y los ojos.
Referencias
- Salud y Riesgos.com, (s.f), Definición, conceptos y artículos sobre salud, riesgos y medio ambiente. Recuperado: saludyriesgos.com
- Sulfuro de aluminio. (s.f). En Wikiwand. Recuperado el 9 de marzo de 2018: wikiwand.com
- Web Elements.(s.f).Dialuminium Trisulpfide, recuperado el 10 de marzo de 2018: webelements.com
- LTS Research Laboratories, Inc (2016), Safety Data Sheet Aluminum Sulfide: ltschem.com
