Laminina: características, estructura, funciones, tipos
La laminina es una de las proteínas que constituye la matriz extracelular de la membrana basal de los tejidos epiteliales en los animales vertebrados. Este tipo de proteínas proporciona un soporte de unión entre las células de los tejidos conjuntivos, de modo que funcionan en la cohesión y compactación de estos.
Generalmente, las lamininas se encargan de ordenar la intrincada red de proteínas que conforma la matriz extracelular o membrana basal de los tejidos. Típicamente las lamininas se encuentran asociadas a proteínas como el colágeno, los proteoglicanos, la entactinas y los heparán sulfatos.
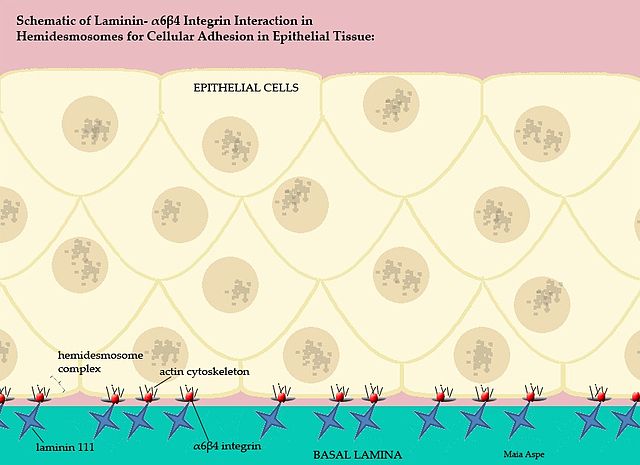
Esta intrincada membrana basal, ordenada por las lamininas, separa las partes epiteliales de los tejidos, es decir, cada matriz extracelular separa el endotelio del mesoteltio y la matriz extracelular del mesotelito separa a esta capa del epitelio.
Muchas investigaciones han demostrado que la expresión de genes de lamininas mutados es potencialmente letal para una célula, ya que estas también se encargan de regular casi todas las complejas interacciones que ocurren dentro de la membrana basal.
Existe una gran diversidad de familias de lamininas en todos los vertebrados. Estas varían en composición, forma, función y origen. En un mismo individuo, en tejidos diferentes, pueden encontrarse lamininas diferentes, cada una adaptada al entorno del tejido que la expresa.
Índice del artículo
Los monómeros o unidades de laminina están formados por un heterotrímero de tres cadenas de glucoproteínas diferentes. Estas proteínas contienen muchos dominios diferentes (multidominios) y son parte esencial para el desarrollo embrionario temprano de los tejidos.
La forma común de las lamininas es una especie de “cruz” o de “Y”, aunque algunas poseen forma de barra larga con cuatro ramificaciones. Esta pequeña variación le permite a cada tipo de laminina regular la integración adecuada desde cualquier posición en el tejido.
Las lamininas poseen un elevado peso molecular, que puede variar dependiendo del tipo de laminina, de 140 hasta 1000 kDa.
Por lo general, cada membrana basal posee uno o varios tipos diferentes de lamininas en su interior y algunos científicos proponen que las lamininas determinan una gran parte de la función fisiológica de las membranas basales del tejido donde se encuentran.
En los animales vertebrados se han encontrado al menos 15 tipos diferentes de lamininas, clasificadas en una familia, ya que están formadas a partir de los mismos trímeros, pero con combinaciones distintas. En los animales invertebrados se han encontrado entre 1 y 2 trímeros distintos.
Estudios actuales sugieren que las lamininas de todos los animales vertebrados surgieron a través de la diferenciación de genes ortólogos, es decir que todos los genes que codifican para lamininas tienen un origen común desde los animales invertebrados.
A pesar de la gran cantidad de funciones que regulan las lamininas, estas poseen una estructura bastante simple que, en su mayoría, se conserva entre los diferentes tipos que se conocen.
Cada laminina se compone de tres cadenas diferentes entrelazadas entre sí formando una especie de “fibra entretejida”. Cada una de las tres cadenas es identificada como alfa (α), beta (β) y gamma (γ).
La formación del trímero de cada laminina depende de la unión de la región C-terminal de cada una de sus cadenas. En el interior de cada molécula, estas cadenas se emparejan a través de enlaces peptídicos y tres puentes disulfuro que le otorgan a la estructura una gran resistencia mecánica.
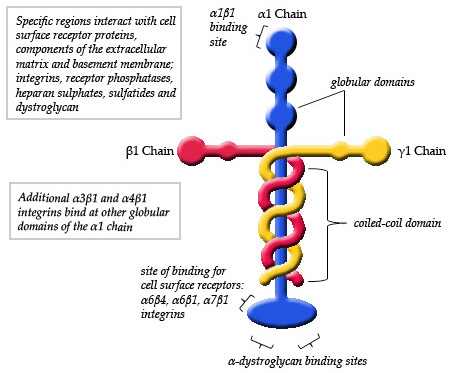
Las observaciones realizadas mediante microscopia electrónica de los monómeros típicos de laminina han detallado que la estructura es una especie de cruz asimétrica que posee un brazo largo de aproximadamente 77 nm (nanómetros) que se caracteriza por una forma globular prominente en uno de sus extremos.
Además, se observan tres brazos cortos, dos de aproximadamente 34 nm y uno de aproximadamente 48 nm. Cada brazo termina en un extremo globular, similar al de la cadena principal, pero más pequeño en tamaño.
La diferencia entre los distintos tipos de lamininas se debe principalmente a las diferencias en las cadenas α, que pueden plegarse en al menos tres formas diferentes; aunque en la actualidad se han identificado variaciones para todas las cadenas:
- 5 variaciones o cadenas diferentes de la laminina α
- 3 variaciones de las cadenas β
- 3 variaciones para las cadenas γ
La función más importante y comúnmente estudiada de las lamininas es la de la interacción con los receptores que se anclan en las membranas celulares de las células adyacentes a las membranas basales donde estas se encuentran.
Esta interacción hace que dichas proteínas se vean implicadas en la regulación de múltiples actividades celulares y vías de señalización. Es debido mencionar que sus funciones dependen de su interacción con receptores específicos en la superficie celular (muchos de los receptores membranales se clasifican actualmente de acuerdo con su capacidad de unión a lamininas).
Las integrinas son los receptores que interactúan con las lamininas y los receptores “no integrinas” son aquellos que no tienen la capacidad de unirse a estas proteínas. La mayor parte de los receptores de tipo “no integrina” son proteoglicanos, algunos distroglicanos o sindecanos.
La maduración de los tejidos de los órganos corporales transcurre con un reemplazo de lamininas tempranas, las cuales se alojaban inicialmente en la membrana basal de los tejidos que conformaban los órganos juveniles.
Dentro de las lamininas el tipo que más se ha estudiado es la laminina-1, que está directamente vinculada con el crecimiento de axones de prácticamente cualquier tipo de neurona en condiciones in vitro, puesto que estas regulan el movimiento del “cono de crecimiento” en la superficie de las neuronas.
Los bioquímicos consideran a la familia de lamininas como una familia de proteínas muy grande, de la cual aún se conocen pocos de sus miembros. Sin embargo, las herramientas modernas permitirán que, en poco tiempo, se vislumbren nuevos tipos de lamininas.
Tales proteínas son identificadas cada una con un número, comenzando por el 1 terminando la numeración en 15 (laminina-1, laminina-2… laminina-15).
También se utiliza otro tipo de nomenclatura, que indica cual es el tipo de cadena que posee cada laminina. Por ejemplo, la laminina-11 está compuesta por una cadena alfa (α)-5, por una cadena beta (β)-2 y por una cadena gamma (γ)-1, por lo que puede nombrarse laminina-521.
Además, cada laminina es clasificada según la función que con la que se asocie y también según el tejido específico del cuerpo en el que participa. Algunos ejemplos de lamininas son:
- Lamina-1: que participa en el desarrollo epitelial
- Laminina-2: involucrada en el desarrollo miogénico de todos los tejidos, del sistema nervioso periférico y de la matriz de los glomérulos.
- Lamina-3: participa en las uniones mio-tendinosas
- Lamina-4: funciona en las uniones neuromusculares y en la matriz mesangial de los glomérulos
- Laminina-5, 6 y 7: actúan preferentemente en los tejidos epidérmicos.
- Miner, J. H., & Yurchenco, P. D. (2004). Laminin functions in tissue morphogenesis. Annu. Rev. Cell Dev. Biol., 20, 255-284.
- Rasmussen, D. G. K., & Karsdal, M. A. (2016). Laminins. In Biochemistry of Collagens, Laminins and Elastin (pp. 163-196). Academic Press.
- Sasaki, T., Fässler, R., & Hohenester, E. (2004). Laminin: the crux of basement membrane assembly. The Journal of cell biology, 164(7), 959-963.
- Timpl, R., Engel, J., & Martin, G. R. (1983). Laminin—a multifunctional protein of basement membranes. Trends in Biochemical Sciences, 8(6), 207-209.
- Timpl, R., Rohde, H., Robey, P. G., Rennard, S. I., Foidart, J. M., & Martin, G. R. (1979). Laminin–a glycoprotein from basement membranes. Journal of Biological Chemistry, 254(19), 9933-9937.
- Tryggvason, K. (1993). The laminin family. Current opinion in cell biology, 5(5), 877-882.
