Fosfato de potasio (K3PO4): estructura, propiedades, usos
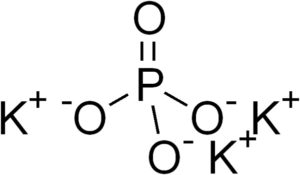
El fosfato de potasio es un compuesto inorgánico formado por tres iones potasio K+ y un ion fosfato PO43-. Su fórmula química es K3PO4. Es un sólido incoloro o blanco cristalino. Es muy soluble en agua, formando soluciones alcalinas, esto es, con muchos iones OH–, por lo tanto, pH básico.
El ion fosfato tiene una función importante en las células que tiene que ver con el almacenamiento de energía. El fosfato de potasio se usa ampliamente en reacciones de química orgánica en las que puede actuar como base, es decir, tomando protones H+. También puede funcionar como catalizador o acelerador de algunas reacciones.

Se ha utilizado para disminuir el ataque de ciertos insectos en plantas de trigo pues las hace más resistentes a estos. Sin embargo, se ha observado que favorece el desprendimiento de metano (CH4), un gas de efecto invernadero, de microcultivos de arroz.
Se ha empleado como laxante, para aumentar el tiempo de duración de una anestesia local, para frenar caries y para ayudar a recubrir superficies, entre otras aplicaciones.
Índice del artículo
El fosfato de potasio está formado por tres cationes potasio K+ y un anión fosfato PO43-.
El ion fosfato PO43- está formado por un átomo de fósforo (P) y cuatro átomos de oxígeno (O), donde el fósforo tiene un estado de oxidación de +5 y los oxígenos una valencia de -2.
- Fosfato de potasio
- Fosfato de tripotasio
- Fosfato tribásico de potasio
- Ortofosfato de tripotasio
Sólido incoloro o blanco cristalino.
212,27 g/mol
1340 ºC
2,564 g/cm3
Muy soluble en agua: 106 g/100 g de agua a 25 °C. Insoluble en etanol.
Una solución con 1% de K3PO4 tiene un pH de 11,5-12,3.
Al disolverse en agua el fosfato de potasio se separa en los tres cationes potasio K+ y el anión fosfato PO43-. El anión fosfato toma un protón del agua y se forma el anión hidrogenofosfato HPO42-. Este último a su vez toma otro protón del agua y se convierte en el anión dihidrogenofosfato H2PO4–.
PO43- + H2O ⇔ HPO42- + OH-
HPO42- + H2O ⇔ H2PO4– + OH–
Al formarse iones OH– la solución acuosa se vuelve alcalina.
Además de la forma anhidra (sin agua), posee varias formas hidratadas; esto significa que la molécula de K3PO4 puede ir acompañada de una o más moléculas de agua dentro de la estructura cristalina.
Por esta razón puede formar por ejemplo el monohidrato K3PO4.H2O, el trihidrato K3PO4.3H2O, el heptahidrato y el nonahidrato.
El ion fosfato PO43- es el anión más abundante del interior de las células y ejerce una función importante en el almacenamiento de energía.
El ion fosfato también participa en actividades de formación y nutrición de los huesos y dientes, pues regula la concentración de calcio en el suero sanguíneo y en numerosas reacciones de transferencia de energía en la célula.
El fosfato de potasio se puede obtener partiendo de la reacción entre el cloruro de potasio KCl y el fosfato de amonio (NH4)3PO4.
Cloruro de potasio + Fosfato de amonio → Fosfato de potasio + Cloruro de amonio
3 KCl + (NH4)3PO4 → K3PO4 + 3 NH4Cl
El fosfato de potasio K3PO4 se ha utilizado en varias reacciones de química orgánica. Por ejemplo sirve en la síntesis de acetilenos partiendo de compuestos dibromados.
En dicha síntesis ocurre una deshidrobromación (eliminación de hidrógeno y bromo), donde el K3PO4 sólido anhidro (sin agua) actúa como una base suave y toma dos protones de la molécula, se eliminan los dos átomos de bromo y se obtiene el acetileno correspondiente.
C6H5-CHBr-CH2Br + 2 K3PO4 → C6H5-C≡CH + 2 KBr + 2 K2HPO4

El K3PO4 sirve como catalizador en diversas reacciones de química orgánica. Por ejemplo, se ha empleado como sólido para la obtención de biodiesel a partir de aceite para freír usado.
El biodiesel es un combustible similar al diésel pero obtenido a partir de grasas o aceites naturales usados o no.
El fosfato de potasio resultó más efectivo como catalizador o acelerador de dicha reacción que el fosfato de sodio Na3PO4 y el óxido de calcio CaO.
El K3PO4 se ha utilizado para tratar plantas de trigo y hacerlas resistentes a ciertas plagas.

Algunos investigadores trataron plántulas de trigo con fosfato de potasio y resultó que este induce resistencia contra el áfido Diuraphis noxia, un insecto que ataca dichas plantas.
Tras aplicar una solución diluida de K3PO4 sobre las plántulas se observó menos severidad de los síntomas causados por esos insectos y disminución del número de áfidos alimentándose de estas.

El fosfato de potasio se ha empleado para modificar el efecto anestésico de la lidocaína, un anestésico local. Un anestésico local es un fármaco que cuando se aplica en una zona del cuerpo produce pérdida de sensibilidad al dolor en esa zona.
Se encontró que el K3PO4 permite prolongar la anestesia local de la lidocaína.
El fosfato de potasio aumenta la fluidez del contenido intestinal pues ayuda a retener el agua en el intestino, lo que induce de forma indirecta a la contracción del músculo intestinal.
El K3PO4 se utiliza en animales con cetoacidosis diabética (una complicación de la diabetes) para tratar la hipofosfatemia (poca cantidad de fosfato en la sangre).
Sin embargo, cuando se suministra en exceso puede causar hipocalcemia (poco calcio en la sangre), hiperfosfatemia (exceso de fosfato en la sangre), contracción involuntaria de los músculos, mineralización de los tejidos blandos y fallo de los riñones.
El fosfato de potasio se ha empleado como buffer para purificar ADN en los laboratorios de genética.
El ADN es una proteína que se encuentra en las células y contiene toda la información genética necesaria para el desarrollo y funcionamiento de los seres vivos.
Al aislar el ADN los científicos ahondan en el estudio de cómo se transmiten los caracteres hereditarios, por lo que el fosfato de potasio resulta de mucha ayuda.
El fosfato de potasio K3PO4 sirve:
- como suplemento dietético,
- para reemplazo de electrolitos,
- como buffer, esto es, como un sistema químico que permite controlar los niveles de iones OH– o hidrógeno H+ en solución acuosa,
- para frenar o inhibir la formación de caries dentales,
- como inhibidor de corrosión y agente antiincrustante,
- como agente para tratar superficies y agente de recubrimiento,
- como anticongelante,
- en productos de limpieza.

Ciertos investigadores encontraron que al añadir K3PO4 a un microcultivo de arroz se incrementa la emisión de metano (CH4) a la atmósfera. El metano es un gas que contribuye al efecto invernadero y al aumento de la temperatura de nuestro planeta.
- U.S. National Library of Medicine. (2019). Potassium phosphate. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Panciera, D.L. (2012). Fluid Therapy in Endocrine and Metabolic Disorders. Phosphorus Supplementation. In Fluid, Electrolyte, and Acid-Base Disorders in Small Animal Practice (Fourth Edition). Recuperado de sciencedirect.com.
- Shenawi-Khalil, S. et al. (2012). Synthesis of acetylenes via dehydrobromination using solid anhydrous potassium phosphate as the base under phase-transfer conditions. Tetrahedron Letters, Volume 53, Issue 18, 2012, Pages 2295-2297. Recuperado de sciencedirect.com.
- Guan, G. et al. (2009). Tri-potassium phosphate as a solid catalyst for biodiesel production from waste cooking oil. Fuel Processing Technology, Volume 90, Issue 4, 2009, Pages 520-524. Recuperado de sciencedirect.com.
- Kulkami, M.A. (2012). Mechanistic approach for expeditious and solvent-free synthesis of α-hydroxy phosphonates using potassium phosphate as catalyst. Comptes Rendus Chimie, Vol 16, Issue 2, 2013, Pages 148-152. Recuperado de sciencedirect.com.
- Venter, E. et al. (2014). Potassium phosphate induces tolerance against the Russian wheat aphid (Diuraphis noxia, Homoptera: Aphididae) in wheat. Crop Protection Vol 61, July 2014, Pages 43-50. Recuperado de sciencedirect.com.
- Bonturi, N. et al. (2013). Sodium citrate and potassium phosphate as alternative adsorption buffers in hydrophobic and aromatic thiophilic chromatographic purification of plasmid DNA from neutralized lysate. Journal of Chromatography B, Volumes 919-920, 2013, Pages 67-74. Recuperado de sciencedirect.com.
- Conrad, R. and Klose, M. (2005). Effect of potassium phosphate fertilization on production and emission of methane and its 13C-stable isotope composition in rice microcosm. Soil Biology and Biochemistry, Vol 37, Issue 11, 2005, Pages 2099-2108. Recuperado de sciencedirect.com.
- Lide, D.R. (editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Smokefoot. (2019). Tripotassium phosphate. Recuperado de en.wikipedia.org
