Cianuro de sodio (NaCN): estructura, propiedades, riesgos, usos
El cianuro de sodio es una sal inorgánica formada por un catión sodio Na+ y un anión cianuro CN–. Su fórmula química es NaCN. Conocido también como cianuro sódico, es un sólido cristalino blanco. Es higroscópico, es decir, absorbe agua del ambiente, y sus cristales son cúbicos como el cloruro de sodio NaCl.
Al disolverse en agua tiende a formar cianuro de hidrógeno HCN. Sus soluciones disuelven el oro y la plata con facilidad. Esta característica hace que sea usado para extraer oro y plata de sus minerales. Las soluciones empleadas para este fin se reciclan, es decir, se reutilizan varias veces.

Sin embargo, algo del cianuro logra escapar a ciertos estanques de desechos, lo que representa un peligro para la fauna y para el ser humano, pues el cianuro es muy tóxico y puede causar la muerte.
El NaCN se usa en la industria química como intermediario para preparar varios tipos de compuestos, como por ejemplo, colorantes, químicos para la agricultura y fármacos o medicamentos.
El cianuro de sodio es un compuesto muy peligroso pues puede causar la muerte, por lo que debe manipularse con precaución extrema.
Índice del artículo
El cianuro de sodio está formado por un ion Na+ y un ion CN-.
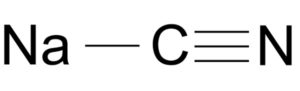
El ion cianuro posee un átomo de carbono C y uno de nitrógeno N unidos entre sí por un enlace triple.
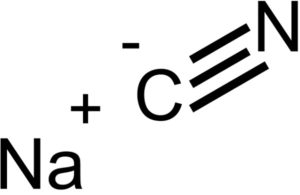
El NaCN posee la misma estructura cristalina que el NaCl, por lo que sus cristales son cúbicos.
-Cianuro de sodio
-Cianuro sódico
Sólido cristalino blanco higroscópico (absorbe agua del ambiente).
49,007 g/mol
563,7 ºC
1496 ºC
No es inflamable. Pero si resulta expuesto a un incendio se produce cianuro de hidrógeno HCN y óxidos de nitrógeno.
1,595 g/cm3 a 20 ºC
Muy soluble en agua: 48 g/100 mL a 10ºC, 82 g/100 mL a 35 ºC. Ligeramente soluble en alcohol
Se hidroliza en solución acuosa generando cianuro de hidrógeno HCN. La constante de esta hidrólisis es Kh = 2,5 x 10-5.
Las soluciones acuosas de NaCN son fuertemente alcalinas
Al disolverse en agua se separa en sus iones Na+ y CN–. En solución acuosa el ion cianuro CN– toma un protón H+ del agua H2O formando HCN y un ion OH–, por lo que la solución se vuelve alcalina.
CN– + H2O → HCN + OH–
Por esta razón, sus soluciones acuosas se descomponen rápidamente al permanecer almacenadas, formando cianuro de hidrógeno HCN.
Es corrosivo hacia el aluminio. Sus soluciones disuelven fácilmente el oro Au y a plata Ag en presencia de aire.
Es un agente quelante pues el anión cianuro CN– puede unirse fácilmente a otros metales, como plata, oro, mercurio, cinc, cadmio, etc.
Presenta un débil olor a almendras amargas.
Debe manejarse con mucho cuidado. Es un compuesto altamente venenoso, inhibe importantes procesos metabólicos, y conduce a la muerte tanto por ingestión, inhalación, absorción por la piel o contacto con los ojos.
Si se inhala el NaCN se disuelve en la mucosa del tracto respiratorio y pasa al torrente sanguíneo. El ion cianuro del NaCN posee una fuerte afinidad por el hierro en estado de oxidación de +3, es decir el catión férrico Fe3+.
Cuando el cianuro es absorbido, reacciona rápidamente con el Fe3+ de una importante enzima de las mitocondrias de las células (la citocromo oxidasa), impidiendo que se realicen ciertos procesos de la respiración de esta.
Por lo tanto, la respiración celular es inhibida o frenada y resulta hipoxia citotóxica. Significa que las células y tejidos son incapaces de utilizar el oxígeno, especialmente células del cerebro y del corazón.
De esta forma, se producen daños permanentes o letales para el organismo. Esto puede ocurrir tanto en humanos como en animales.
Si se ingiere causa congestión de los vasos sanguíneos y corrosión de la mucosa gástrica, además de lo ya mencionado.

No es combustible, pero en contacto con ácidos, libera HCN que es altamente inflamable y tóxico.
Si se funde con nitritos o cloratos puede explotar.
Puede obtenerse con sodio Na, amoníaco NH3 y carbón C. El sodio reacciona con el amoníaco dando amida sódica NaNH2:
2 Na + 2 NH3 → 2 NaNH2 + H2↑
La amida de sodio se calienta con carbón a 600 ºC y produce cianamida de sodio Na2NCN, que luego con carbón a 800 ºC se convierte en cianuro sódico:
2 NaNH2 + C → 2 H2↑ + Na2NCN
Na2NCN + C → 2 NaCN
Otro método consiste en fundir cianamida de calcio CaNCN y carbón C con carbonato de sodio Na2CO3:
CaNCN + C + Na2CO3 → CaCO3 + 2 NaCN
También se puede preparar haciendo pasar gas nitrógeno N2 por una mezcla caliente de carbonato de sodio Na2CO3 y carbón C en polvo, utilizando hierro Fe como catalizador o acelerador de la reacción:
Na2CO3 + 4 C + N2 → 2 NaCN + 3 CO↑
El cianuro de sodio se ha utilizado desde hace mucho tiempo para extraer los metales oro y plata de sus minerales.
El cianuro empleado en el proceso se recicla, pero algo escapa al estanque de residuos junto con los metales pesados no recuperados.
Los pájaros, murciélagos y otros animales que beben de estas lagunas con cianuro han resultado envenenados.
Hay registros de una represa en Rumanía que mantenía aislado un estanque de residuos y que fue dañada por un evento del clima.
Como consecuencia quedaron liberadas toneladas de cianuro al río Sasar y sistemas acuíferos cercanos como los ríos Lapus, Somes, Tisza, finalizando en el Danubio.
Esto causó una cascada de muertes de animales, o en otras palabras, un desastre ecológico.

El cianuro de sodio NaCN es utilizado en la síntesis de varios tipos de compuestos orgánicos.
Se preparan, por ejemplo, pigmentos y colorantes (incluyendo abrillantadores ópticos), compuestos para uso en agricultura o agroquímicos y diversos productos farmacéuticos.
También sirve para obtener agentes quelantes o secuestrantes de iones metálicos.
Con el cianuro de sodio NaCN se preparan los compuestos llamados nitrilos, los cuales al ser tratados con solución acuosa caliente ácida o alcalina permite obtener ácidos carboxílicos.
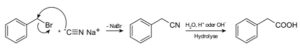
Permite preparar ácidos grasos con grupos ciano, cianuros de metales pesados y ácido cianhídrico o cianuro de hidrógeno HCN.
El NaCN se usa en las soluciones que se emplean en galvanoplastia o electrodeposición de metales (recubrimiento de metales con otros) por ejemplo de cinc.
Es un componente del acero endurecido. También sirve en la limpieza de metales.
El cianuro de sodio es un intermediario en la fabricación del nylon.
Sirve para la separación de minerales por flotación con espuma.
El NaCN se usaba para eliminar roedores, como conejos y ratas y sus madrigueras, y para acabar con nidos de termitas.
Actualmente se emplea de forma ocasional para eliminar coyotes, zorros y perros silvestres. Se usa en forma de cápsulas como dosis sencillas o múltiples en tierras de pastoreo, terrenos de caza y bosques.
Debido a su toxicidad extrema, el NaCN debe ser utilizado solamente por personas preparadas.
Este uso se considera muy peligroso para el ser humano, pero hay quienes aún lo utilizan.

En agricultura se usaba antiguamente para fumigar árboles de frutas cítricas y otras frutas. También se empleaba como insecticida y miticida (eliminador de ácaros) para ser aplicado luego de la cosecha, para cítricos no almacenados o para la fumigación de camiones usados para transportarlos. También se empleó para fumigar barcos, coches ferroviarios y almacenes.
Todos estos usos han sido cuestionados por la alta toxicidad del cianuro de sodio. Por esta razón, ya no se emplea o solo muy raras veces y bajo condiciones muy controladas.
- U.S. National Library of Medicine. (2019). Sodium cyanide. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Fourth Edition. John Wiley & Sons.
- Hurst, H.E. and Martin, M.D. (2017). Toxicology. Cyanide. In Pharmacology and Therapeutics for Dentistry (Seventh Edition). Recuperado de sciencedirect.com.
- Coppock, R.W. and Dziwenka, M. (2015). Threats to Wildlife by Chemical Warfare Agents. In Handbook of Toxicology of Chemical Warfare Agents (Second Edition). Recuperado de sciencedirect.com.
- Morrison, R.T. and Boyd, R.N. (2002). Organic Chemistry. 6th Edition. Prentice-Hall.
