Tolueno: estructura, propiedades, usos, obtención
El tolueno es un hidrocarburo aromático cuya fórmula condensada es C6H5CH3 o PhCH3 y que consiste de un grupo metilo (CH3) unido a un anillo bencénico o grupo fenilo (Ph). Se encuentra naturalmente en el petróleo crudo, en el carbón, en las emanaciones volcánicas y en algunos árboles, como el árbol tolú de América del Sur.
Este solvente de olor característico se utiliza principalmente como materia prima industrial, y como diluyente de pinturas. También es usado en la eliminación de parásitos presentes en los gatos y los perros, tales como ascáridos y anquilostomos.
El tolueno fue aislado por vez primera por Pierre-Joseph Pelletier y Philippe Walter, en 1837, del aceite de pino. Posteriormente, Henri Étienne Sainte-Claire Deville, en 1841, lo aisló del bálsamo tolú y señaló que su producto era semejante al aislado previamente. En 1843, Berzelius lo bautizó como toluin.
La mayor parte del tolueno es obtenido como un producto lateral o secundario en los procesos de producción de la gasolina y la conversión del carbón en coque. También se produce por reacciones realizadas en el laboratorio, por ejemplo, la reacción del benceno con el cloruro de metilo.
Índice del artículo
- 1 Estructura
- 2 Propiedades
- 2.1 Apariencia física
- 2.2 Masa molar
- 2.3 Olor
- 2.4 Densidad
- 2.5 Punto de fusión
- 2.6 Punto de ebullición
- 2.7 Solubilidad
- 2.8 Índice de refracción (nD)
- 2.9 Viscosidad
- 2.10 Punto de ignición
- 2.11 Densidad de vapor
- 2.12 Presión de vapor
- 2.13 Temperatura de auto ignición
- 2.14 Descomposición
- 2.15 Tensión superficial
- 2.16 Momento dipolar
- 2.17 Reactividad
- 3 Usos
- 4 Obtención
- 5 Efectos dañinos
- 6 Referencias
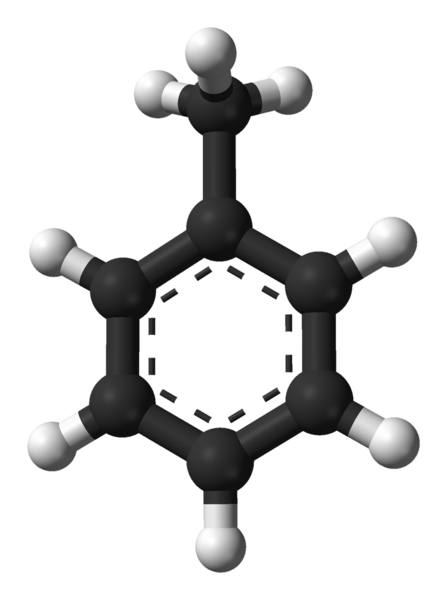
En la imagen superior tenemos la estructura molecular del tolueno representada por un modelo de esferas y barras. Nótese que luce exactamente igual como indicaba la fórmula estructural, con la diferencia de que no se trata de una molécula plana por completo.
En el centro del anillo bencénico, que en este caso puede verse como un grupo fenilo, Ph, se resalta su carácter aromático mediante las líneas punteadas. Todos los átomos de carbono tienen hibridación sp2, a excepción el del grupo CH3, cuya hibridación es sp3.
Es por esta razón que la molécula no es plana por completo: los hidrógenos del CH3 se sitúan a distintos ángulos del plano del anillo bencénico.
El tolueno es una molécula apolar, hidrofóbica y aromática. Sus interacciones intermoleculares se basan en las fuerzas dispersivas de London, y en interacciones dipolo-dipolo, ya que el centro del anillo se encuentra “cargado” de densidad electrónica aportada por el CH3; mientras que los átomos de hidrógeno, presentan baja densidad electrónica.
Por lo tanto, el tolueno cuenta con varios tipos de interacciones intermoleculares que mantienen cohesionadas las moléculas de su líquido. Esto se refleja en su punto de ebullición, 111 °C, el cual es alto considerando que se trata de un solvente apolar.
Líquido incoloro y transparente
92,141 g/mol
Dulzón, acre y semejante al del benceno
0,87 g/mL a 20 ºC
-95 ºC
111 ºC
El tolueno tiene una solubilidad despreciable en agua: 0,52 g/L a 20 °C. Esto debido a la diferencia de polaridades entre el tolueno y el agua.
Por otro lado, el tolueno es soluble, o en este caso miscible, con el etanol, benceno, éter etílico, acetona, cloroformo, ácido acético glacial y disulfuro de carbono; es decir, se solubiliza mejor en solventes menos polares.
1,497
0,590 cP (20 ºC)
6 ºC. El tolueno debe manipularse en campas extractoras de gases y lo más alejado posible de cualquier llama.
3,14 en relación al aire = 1. Es decir, sus vapores son tres veces más densos que el aire.
2.8 kPa a 20 °C (alrededor de unas 0.27 atm).
480 °C
Puede reaccionar vigorosamente con materiales oxidantes. Cuando se calienta a descomposición, emite un humo acre e irritante.
29,46 mN a 10 ºC
0,36 D
El tolueno es propenso a la cloración para producir orto-clorotolueno y para-clorotolueno. También es fácil de nitrificar para producir nitrotolueno, el cual es la materia prima de los tintes.
Una parte de tolueno se combina con tres partes de ácido nítrico para originar trinitrotolueno (TNT): uno de los explosivos más conocidos.
Asimismo, el tolueno experimenta sulfonación para generar los ácidos o-toluen-sulfónico y p-toluen-sulfónico, que son la materia prima para la fabricación de tintes y sacarina.
El grupo metilo del tolueno experimenta pérdida de hidrógeno por la acción de una base fuerte. También el grupo metilo es susceptible a la oxidación, por lo que reacciona con el permanganato de potasio para originar ácido benzoico y benzaldehído.

El tolueno es utilizado en la elaboración de pinturas, diluyentes de pinturas, pulidos de uñas, adhesivos o gomas de pegar, lacas, tintas, nylon, plástico, la espuma de poliuretano, la mayoría de los aceites, organosoles de vinilo, medicamentos, colorantes, perfumes, explosivos (TNT).
De la misma forma, el tolueno es utilizado bajo la forma de toluenosulfonados en la fabricación de detergente. El tolueno también es de gran importancia en la fabricación de cementos plásticos, removedores de mancha cosméticos, anticongelantes, tintas, asfalto, marcadores permanentes, cementos por contacto, etc.
El tolueno se emplea en la dilución de las pinturas, lo que facilita su aplicación. Se usa para disolver los bordes de los kits de poliestireno, permitiendo así la unión de las partes que constituyen modelos de aviones a escala. Además, se usa en la extracción de productos naturales de las plantas.
El tolueno es un solvente de tintas usadas en el hueco grabado. Los cementos mezclados con caucho y tolueno se utilizan para recubrir gran cantidad de productos. Asimismo, se emplea el tolueno como solvente en tintas de impresión, lacas, curtidores de cuero, pegamentos y desinfectantes.
Y aún más interesante, el tolueno se utiliza como disolvente de los nanomateriales de carbono (como los nanotubos) y los fullerenos.
Una mezcla de benceno, tolueno y xileno (BTX) se agrega a la gasolina para incrementar su octanaje. El tolueno es un aditivo de la gasolina de avión y reserva de alto octanaje. También se utiliza en la elaboración de la nafta.
El tolueno ayuda en la eliminación de algunas especies de ascárides y anquilostomos, así como de tenias que son parásitos de gatos y perros.
La mayor parte del tolueno se obtiene de productos destilados del petróleo crudo, generados durante la pirolisis de hidrocarburos (craqueo por vapor). La reforma catalítica de los vapores de petróleo representa el 87 % del tolueno producido.
Se separa un 9 % adicional de tolueno de la gasolina de pirolisis producida durante la fabricación de etileno y propileno.
El alquitrán de hulla de los hornos de coque aporta el 1 % del tolueno producido, mientras que el 2 % restante se obtiene como un subproducto de la fabricación del estireno.
El tolueno es un solvente que es inhalado para drogarse, ya que tiene una acción narcótica que afecta el funcionamiento del sistema nervioso central. El tolueno ingresa al organismo por ingestión, inhalación y absorción a través de la piel.
A un nivel de exposición de 200 ppm, puede producirse excitación, euforia, alucinaciones, percepciones distorsionadas, dolor de cabeza y mareos. Mientras niveles más elevados de exposición al tolueno pueden producir depresión, somnolencia y estupor.
Cuando la inhalación supera una concentración de 10.000 ppm, es capaz de producir la muerte del individuo por insuficiencia respiratoria.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Morrison y Boyd. (1987). Química orgánica. (Quinta edición). Addison-Wesley Iberoamericana.
- National Center for Biotechnology Information. (2020). Toluene. PubChem Database., CID=1140. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2020). Toluene. Recuperado de: en.wikipedia.org
- Engineering ToolBox, (2018). Toluene – Thermophysical Properties. [online] Recuperado de: engineeringtoolbox.com
- Vedantu. (s.f.). Toluene. Recuperado de: vedantu.com
