Fosfatidiletanolamina: estructura, biosíntesis y funciones
La fosfatidiletanolamina (PE) es un glicerofosfolípido abundande en las membranas plasmáticas de organismos procariotas. Al contrario, en las membranas celulares eucariotas este es el segundo glicerofosfolípido más abundante en la cara interna de la membrana plasmática después de la fosfatidilcolina.
No obstante la abundancia de la fosfatidiletanolamina, su abundancia depende no solo del tipo celular sino también del compartimiento y el momento del ciclo de vida celular específico que se considere.
Las membranas biológicas son barreras que definen a los organismos celulares. No solo tienen funciones de protección y aislamiento, sino que también son claves para el establecimiento de proteínas que requieren un ambiente hidrofóbico para su óptimo funcionamiento.
Tanto eucariotas como procariotas poseen membranas compuestas fundamentalmente por glicerofosfolípidos y en una menor medida esfingolípidos y esteroles.
Los glicerofosfolípidos son moléculas anfipáticas estructuradas sobre un esqueleto de L-glicerol que es esterificado en las posiciones sn-1 y sn-2 por dos ácidos grasos de longitud y grado de saturación variables. En el hidroxilo de la posición sn-3 está esterificado por un grupo fosfato, al que a su vez pueden unirse diferentes tipos de moléculas que dan origen a las diversas clases de glicerofosfolípidos.
En el mundo celular existe una gran variedad de glicerofosfolípidos, sin embargo, los más abundantes son la fosfatidilcolina (PC), fosfatidiletanolamina (PE), fosfatidilserina (PS), fosfatidilinositol (PI), ácido fosfatídico (PA), fosfatidilglicerol (PG) y la cardiolipina (CL).
Índice del artículo
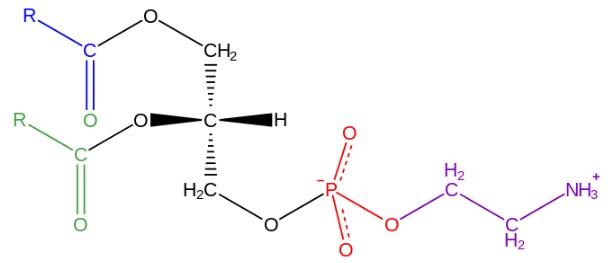
La estructura de la fosfatidiletanolamina fue descubierta por Baer y colaboradores en 1952. Tal y como se ha determinado experimentalmente para todos los glicerofosfolípidos, la fosfatidiletanolamina está formada por una molécula de glicerol esterificada en las posiciones sn-1 y sn-2 con cadenas de ácidos grasos de entre 16 y 20 átomos de carbono.
Los ácidos grasos esterificados en el hidroxilo sn-1 son generalmente saturados (sin dobles enlaces) con longitudes máximas de 18 átomos de carbono, mientras que las cadenas unidas en la posición sn-2, son de mayor longitud y con una o más insaturaciones (dobles enlaces).
El grado de saturación de estas cadenas contribuye a la elasticidad de la membrana, lo que tiene una gran influencia en la inserción y secuestro de proteínas en la bicapa.
La fosfatidiletanolamina es considerada un glicerofosfolípido no lamelar, ya que tiene una forma geométrica cónica. Dicha forma está dada por el pequeño tamaño de su grupo polar o “cabeza”, en relación con el de las cadenas de ácidos grasos que comprenden las “colas” hidrofóbicas.
La “cabeza” o grupo polar de la fosfatidiletanolamina tiene carácter zwitteriónico, es decir que posee grupos que pueden estar cargados positiva y negativamente en determinadas condiciones de pH.
Esta característica le permite establecer enlaces de hidrógeno con una gran cantidad de residuos aminoacídicos y su distribución de cargas es un determinante esencial para la topología de los dominios de muchas proteínas integrales de membrana.
En las células eucariotas la síntesis de lípidos estructurales está geográficamente restringida, siendo el principal sitio de biosíntesis el retículo endoplasmático (ER) y en menor medida el aparato de Golgi.
Existen cuatro rutas biosintéticas independientes para la producción de fosfatidiletanolamina: (1) la ruta de la CDP-etanolamina, también conocida como la ruta Kennedy; (2) la ruta de la PSD para la descarboxilación de la fosfatidilserina (PS); (3) la acilación de liso-PE y (4) las reacciones de cambio de base del grupo polar de otros glicerofosfolípidos.
La biosíntesis de fosfatidiletanolamina por esta ruta está limitada al ER y se ha demostrado que en células hepáticas de Hámster es la principal vía de producción. Consiste en tres pasos enzimáticos consecutivos catalizados por tres enzimas diferentes.
En el primer paso se produce fosfoetanolamina y ADP gracias a la acción de la etanolamina quinasa, que cataliza la fosforilación dependiente de ATP de la etanolamina.
A diferencia de las plantas, ni mamíferos ni levaduras son capaces de producir este sustrato, por lo que debe ser consumido en la dieta u obtenido a partir de la degradación de moléculas de fosfatidiletanolamina o de esfingosina preexistentes.
La fosfoetanolamina es empleada por la CTP: fosfoetanolamina citidiltransferasa (ET) para formar el compuesto de alta energía CDP: etanolamina y un fosfato inorgánico.
La 1,2-diacilglicerol etanolamina fosfotransferasa (ETP) emplea la energía contenida en el enlace CDP- etanolamina para unir covalentemente la etanolamina a una molécula de diacilglicerol inserto en la membrana, dando lugar a la fosfatidiletanolamina.
Esta ruta opera tanto en procariotas como en levaduras y mamíferos. En bacterias ocurre en la membrana plasmática, pero en eucariotas tiene lugar en una zona del retículo endoplasmático que posee estrecha relación con la membrana mitocondrial.
En mamíferos la ruta es catalizada por una sola enzima, la fosfatidilserina descarboxilasa (PSD1p), que está embebida en la membrana mitocondrial, cuyo gen es codificado por el núcleo. La reacción implica la descarboxilación de la PS a fosfatidiletanolamina.
Las dos rutas restantes (acilación de liso-PE e intercambio calcio-dependiente de grupo polar) ocurren en el retículo endoplasmático, pero no contribuyen de forma significativa a la producción total de fosfatidiletanolamina en las células eucariotas.
Los glicerofosfolípidos poseen tres funciones principales en la célula, entre las que destacan las funciones estructurales, de almacenamiento de energía y señalización celular.
La fosfatidiletanolamina está asociada al anclaje, estabilización y plegamiento de múltiples proteínas de membrana, así como también a los cambios conformacionales necesarios para el funcionamiento de muchas enzimas.
Existe evidencia experimental que propone a la fosfatidiletanolamina como un glicerofosfolípido crucial en la etapa tardía de la telofase, durante la formación del anillo contráctil y el establecimiento del fragmoplasto que permite la división de la membrana de las dos células hijas.
Tiene también una función importante en todos los procesos de fusión y fisión (unión y separación) de las membranas tanto del retículo endoplasmático como del aparato de Golgi.
En E. coli se ha comprobado que la fosfatidiletanolamina es necesaria para el correcto plegamiento y función de la enzima lactosa permeasa, por lo que se ha sugerido que tiene un rol de “chaperona” molecular.
La fosfatidiletanolamina es el principal donador de la molécula de etanolamina necesaria para la modificación post-traduccional de numerosas proteínas, como por ejemplo las anclas GPI.
Este glicerofosfolípido es precursor de numerosas moléculas con actividad enzimática. Además, moléculas derivadas de su metabolismo, así como el diacilglicerol, el ácido fosfatídico y algunos ácidos grasos, pueden actuar como segundos mensajeros. Adicionalmente, es un sustrato importante para la producción de fosfatidilcolina.
- Brouwers, J. F. H. M., Vernooij, E. A. A. M., Tielens, A. G. M., & van Golde, L. M. G. (1999). Rapid separation and identification of phosphatidylethanolamine molecular species. Journal of Lipid Research, 40 (1), 164–169. Recuperado de jlr.org
- Calzada, E., McCaffery, J. M., & Claypool, S. M. (2018). Phosphatidylethanolamine produced in the inner mitochondrial membrane is essential for yeast cytochrome bc1 complex function 3. BioRxiv, 1, 46.
- Calzada, E., Onguka, O., & Claypool, S. M. (2016). Phosphatidylethanolamine Metabolism in Health and Disease. International Review of Cell and Molecular Biology (Vol. 321). Elsevier Inc.
- Gibellini, F., & Smith, T. K. (2010). The Kennedy pathway-de novo synthesis of phosphatidylethanolamine and phosphatidylcholine. IUBMB Life, 62(6), 414–428.
- Harayama, T., & Riezman, H. (2018). Understanding the diversity of membrane lipid composition. Nature Reviews Molecular Cell Biology, 19(5), 281–296.
- Luckey, M. (2008). Membrane structural biology: with biochemical and biophysical foundations. Cambrudge University Press. Recuperado de cambrudge.org
- Seddon, J. M., Cevc, G., Kaye, R. D., & Marsh, D. (1984). X-ray Diffraction Study of the Polymorphism of Hydrated Diacyl- and Dialkylphosphatidylethanolamines. Biochemistry, 23(12), 2634–2644.
- Sendecki, A. M., Poyton, M. F., Baxter, A. J., Yang, T., & Cremer, P. S. (2017). Supported Lipid Bilayers with Phosphatidylethanolamine as the Major Component. Langmuir, 33(46), 13423–13429.
- van Meer, G., Voelker, D. R., & Feignenson, G. W. (2008). Membrane lipids: where they are and how they behave. Nature Reviews, 9, 112–124.
- Vance, J. E. (2003). Molecular and Cell Biology of Phosphatidylserine and Phosphatidylethanolamine Metabolism. In K. Moldave (Ed.), Progress Nucleic Acid Research and Molecular Biology (pp. 69–111). Academic Press.
- Vance, J. E. (2008). Phosphatidylserine and phosphatidylethanolamine in mammalian cells: two metabolically related aminophospholipids. Journal of Lipid Research, 49(7), 1377–1387.
- Vance, J. E., & Tasseva, G. (2013). Formation and function of phosphatidylserine and phosphatidylethanolamine in mammalian cells. Biochimica et Biophysica Acta – Molecular and Cell Biology of Lipids, 1831(3), 543–554.
- Watkins, S. M., Zhu, X., & Zeisel, S. H. (2003). Phosphatidylethanolamine-N-methyltransferase activity and dietary choline regulate liver-plasma lipid flux and essential fatty acid metabolism in mice. The Journal of Nutrition, 133(11), 3386–3391.
