Sales de diazonio: qué son, formación, propiedades, aplicaciones
¿Qué son las sales de diazonio?
Las sales de diazonio son compuestos orgánicos en los que existen interacciones iónicas entre el grupo azo (–N2+) y un anión X– (Cl–, F–, CH3COO–, etc.). Su fórmula química general es RN2+X–, y en esta la cadena lateral R puede bien ser un grupo alifático o un grupo arilo; es decir, un anillo aromático.
En la imagen inferior se representa la estructura del ion arenodiazonio. Las esferas azules corresponden al grupo azo, mientras que las negras y blancas componen el anillo aromático del grupo fenilo. El grupo azo es muy inestable y reactivo, debido a que uno de los átomos de nitrógeno posee una carga positiva (–N+≡N).
Sin embargo, existen estructuras de resonancia que deslocalizan esta carga positiva, por ejemplo, en el átomo de nitrógeno vecino: –N=N+. Esta se origina cuando un par de electrones formando enlace se dirige al átomo de nitrógeno de la izquierda.
Asimismo, esta carga positiva es capaz de deslocalizarse por el sistema Pi del anillo aromático. Como consecuencia, las sales de diazonio aromáticas son más estables que las alifáticas, dado que la carga positiva no puede deslocalizarse a lo largo de una cadena carbonada (CH3, CH2CH3, etc.).
Formación
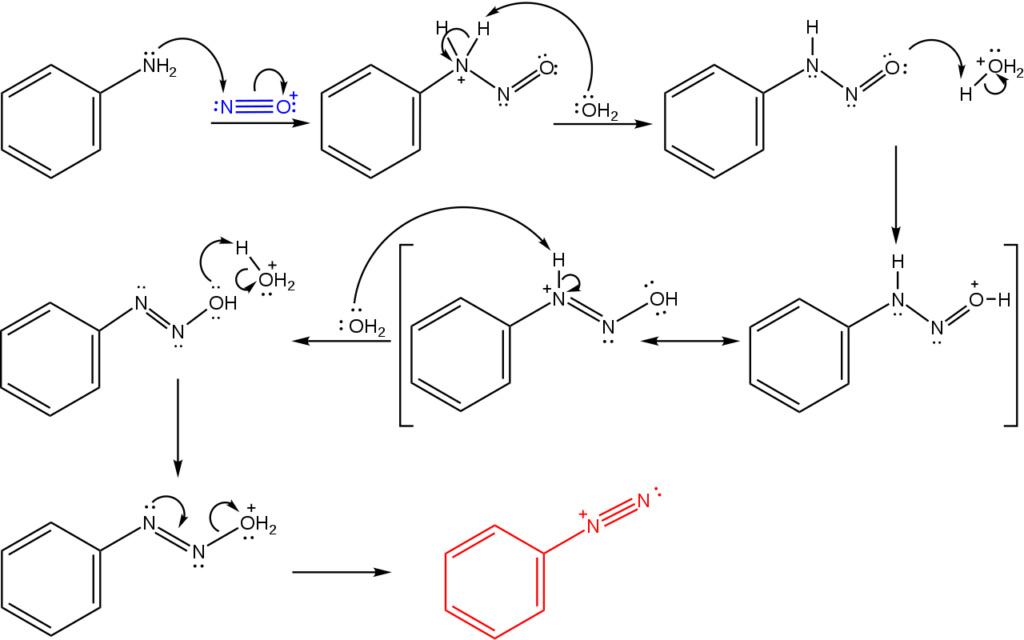
Estas sales derivan de la reacción de una amina primaria con una mezcla ácida de nitrito de sodio (NaNO2).
Las aminas secundarias (R2NH) y terciarias (R3N) originan otros productos nitrogenados como las N-nitrosoaminas (que son aceites amarillentos), sales de aminas (R3HN+X–) y compuestos de N-nitrosoamonio.
La imagen superior ilustra el mecanismo por el cual se rige la formación de las sales de diazonio, o también conocida como reacción de diazotización.
La reacción parte de la fenilamina (Ar–NH2), el cual realiza un ataque nucleofílico sobre el átomo de N del catión nitrosonio (NO+). Este catión es producido por la mezcla NaNO2/HX, donde X generalmente es Cl; es decir, HCl.
La formación del catión nitrosonio libera agua al medio, la cual arrebata un protón al nitrógeno cargado positivamente.
Luego, esta misma molécula de agua (u otra especie ácida distinta de H3O+) cede un protón al oxígeno, deslocalizando la carga positiva en el átomo menos electronegativo de nitrógeno).
Ahora, el agua nuevamente desprotona al nitrógeno, produciéndose entonces la molécula de diazohidróxido (la antepenúltima de la secuencia).
Como el medio es ácido, el diazohidróxido sufre deshidratación del grupo OH; para contrarrestar la vacancia electrónica, el par libre del N forma el triple enlace del grupo azo.
De este modo, al final del mecanismo permanece en solución el cloruro de bencenodiazonio (C6H5N2+Cl–).
Propiedades
Por lo general, las sales de diazonio son incoloras y cristalinas, solubles y estables a bajas temperaturas (menores de 5 ºC).
Algunas de estas sales son tan sensibles al impacto mecánico, que cualquier manipulación física podría detonarlas. Por último, reaccionan con el agua para formar fenoles.
Reacciones de desplazamiento
Las sales de diazonio son potenciales liberadoras de nitrógeno molecular, cuya formación es el denominador común de las reacciones de desplazamiento. En estas, una especie X desplaza al inestable grupo azo, escapando como N2(g).
Reacción de Sandmeyer
ArN2+ + CuCl => ArCl + N2 + Cu+
ArN2+ + CuCN => ArCN + N2 + Cu+
Reacción de Gatterman
ArN2+ + CuX => ArX + N2 + Cu+
A diferencia de la reacción de Sandmeyer, la reacción de Gatterman dispone de cobre metálico en lugar de su haluro; es decir, el CuX se genera in situ.
Reacción de Schiemann
[ArN2+]BF4– => ArF + BF3 + N2
La reacción de Schiemann se caracteriza por la descomposición térmica del fluoroborato de bencenodiazonio.
Reacción de Gomberg Bachmann
[ArN2+]Cl– + C6H6 => Ar−C6H5 + N2 + HCl
Otros desplazamientos
ArN2+ + KI => ArI + K+ + N2
[ArN2+]Cl– + H3PO2 + H2O => C6H6 + N2 + H3PO3 + HCl
ArN2+ + H2O => ArOH + N2 + H+
ArN2+ + CuNO2 => ArNO2 + N2 + Cu+
Reacciones redox
Las sales de diazonio pueden ser reducidas a arilhidrazinas, empleando una mezcla de SnCl2/HCl:
ArN2+ => ArNHNH2
También pueden ser reducidas a arilaminas en reducciones más fuertes con Zn/HCl:
ArN2+ => ArNH2 + NH4Cl
Descomposición fotoquímica
[ArN2+]X– => ArX + N2
Las sales de diazonio son sensibles a descomponerse por incidencia de radiación ultravioleta, o a longitudes de onda muy cercanas.
Reacciones de acoplamiento azo
ArN2+ + Ar′H → ArN2Ar′ + H+
Estas reacciones son quizás las más útiles y versátiles de las sales de diazonio. Estas sales son electrófilos débiles (el anillo deslocaliza la carga positiva del grupo azo). Para que reaccionen con compuestos aromáticos, necesitan entonces que estén cargados negativamente, originando así compuestos azos.
La reacción transcurre con un rendimiento eficiente entre un pH de 5 y 7. En pH ácidos el acoplamiento es menor porque el grupo azo se protona, imposibilitando el ataque del anillo negativo.
Asimismo, en pH básicos (mayor a 10) la sal de diazonio reacciona con el OH– para producir diazohidróxido, el cual es relativamente inerte.
Las estructuras de este tipo de compuestos orgánicos disponen de un sistema Pi conjugado muy estable, cuyos electrones absorben y emiten radiación en el espectro visible.
En consecuencia, los compuestos azo se caracterizan por ser coloridos. Debido a esta propiedad se les ha denominado también colorantes azoicos.
La imagen superior ilustra el concepto del acoplamiento azo con el anaranjado de metilo como ejemplo. En el medio de su estructura puede observarse el grupo azo sirviendo como el conector de los dos anillos aromáticos.
¿Cuál de los dos anillos era el electrófilo al inicio del acoplamiento? El de la derecha, debido a que el grupo sulfonato (–SO3) retira densidad electrónica del anillo, haciéndolo aún más electrófilo.
Aplicaciones
Una de sus aplicaciones más comerciales es la producción de colorantes y pigmentos, abarcando asimismo la industria textil en el teñido de telas. Estos compuestos azoicos se anclan a sitios moleculares específicos del polímero, tiñéndolo de colores.
Debido a su descomposición fotolítica, es (menos que antes) empleado en la reproducción de documentos. ¿Cómo? Las áreas del papel cubiertas por un plástico especial son removidas y luego se les aplica una solución básica de fenol, coloreando de azul las letras o el diseño.
En síntesis orgánicas se utilizan como puntos de partida para muchos derivados aromáticos.
Finalmente, están teniendo aplicaciones en el campo de los materiales inteligentes. En estos se enlazan covalentemente a una superficie (de oro, por ejemplo), permitiéndole dar una respuesta química frente a estímulos físicos externos.
